题目内容
7.如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )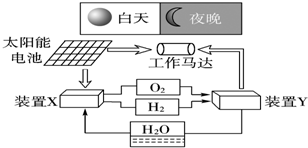
| A. | 二氧化硅是太阳能电池的光电转换材料 | |
| B. | 装置X能实现燃料电池的氢气和氧气再生 | |
| C. | 装置Y中负极的电极反应式为:O2+2H2O+4e-═4OH- | |
| D. | 装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
分析 A.硅电池是太阳能电池的光电转换材料;
B.X装置是电解池,电解水生成氢气和氧气;
C.负极上氢气失电子发生氧化反应;
D.化学能与电能间不可能完全转化,还有部分转化为其它能.
解答 解:A.硅元素处于金属和非金属元素分界线处,具有金属性和非金属性,可以作硅太阳能电池,所以硅电池是太阳能电池的光电转换材料,二氧化硅作光导纤维材料,故A错误;
B.X装置是电解池,电解水生成氢气和氧气,所以装置X能实现燃料电池的氢气和氧气再生,故B正确;
C.负极上氢气失电子发生氧化反应,正极上氧气得电子发生还原反应,Y中正极的电极反应式为:O2+2H2O+4e-═4OH-,故C错误;
D.化学能与电能间不可能完全转化,还有部分转化为其它能,所以装置X、Y形成的子系统能实现物质的零排放,但不能实现化学能与电能间的完全转化,故D错误;
故选B.
点评 本题考查化学电源新型电池,侧重考查原电池原理及能量转化,明确图中发生的反应及能量转化方式,注意电极反应式的书写要结合电解质溶液酸碱性.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.表1是元素周期表的一部分( 注意:以下各空所涉及的元素填元素符号,不能用字母代替)
(1)C的元素符号为Al;
(2)C的离子的结构示意图 ,
,
(3)用电子式表示AE2的形成过程 G元素的最高价氧化物电子式
G元素的最高价氧化物电子式
(4)H元素的单质的电子式 ;H的氢化物的电子式
;H的氢化物的电子式
(5)A-H八种元素中(填化学式)
(a) 原 子 半径最大的元素是K,原子半径最小的元素是F.
(b)单质的还原性最强的元素是K,单质的氧化性最强的元素是F2
(c)酸性最强的最高价氧化物对应水化物是HClO4;
碱性最强的最高价氧化物对应水化物是KOH.
(6)请设计实验比较B、F的金属性强弱顺序.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O族 |
| 1 | ||||||||
| 2 | G | H | D | |||||
| 3 | B | C | E | |||||
| 4 | F | A | ||||||
(2)C的离子的结构示意图
 ,
,(3)用电子式表示AE2的形成过程
 G元素的最高价氧化物电子式
G元素的最高价氧化物电子式
(4)H元素的单质的电子式
 ;H的氢化物的电子式
;H的氢化物的电子式
(5)A-H八种元素中(填化学式)
(a) 原 子 半径最大的元素是K,原子半径最小的元素是F.
(b)单质的还原性最强的元素是K,单质的氧化性最强的元素是F2
(c)酸性最强的最高价氧化物对应水化物是HClO4;
碱性最强的最高价氧化物对应水化物是KOH.
(6)请设计实验比较B、F的金属性强弱顺序.
| 元素 | 实验设计 | 现象 | 结论 |
| B | 分别在两个盛有滴加酚酞的水的烧杯中加入形状相同的Na和K,观察现象 | K在反应中伴随轻微爆炸,钾比钠的反应更剧烈 | 金属性: K>Na |
| F |
19.国家对食品、空气、药品安全问题越来越重视,下列说法中一定正确的是( )
| A. | 欧洲和北美洲的一些大城市上空二氧化氮浓度很高,其原因是这些地区硝酸工业发达 | |
| B. | 大气污染物中的二氧化硫能引起呼吸道疾病 | |
| C. | 天然的药物无任何毒副作用,可长期服用 | |
| D. | 长期食用二氧化硫含量超标的食品会破坏维生素B1,可通过服入碱性物质(如NaOH)的方法来消除二氧化硫中毒 |
16.下列指定反应的离子方程式正确的是( )
| A. | 向烧碱溶液中加入铝:Al+2OH-=AlO2-+H2↑ | |
| B. | 用过量氨水吸收烟道气中的SO2:SO2+2NH3•H2O=SO32-+2NH4++H2O | |
| C. | 将饱和FeCl3溶液滴入废水中制取Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3↓+3H+ | |
| D. | 用Fe2+将饮用水中少量ClO2-还原成为Cl-:4Fe2++ClO2-+4H+=4Fe3++Cl-+2H2O |
17.心酮胺是治疗冠心病的药物,其结构简式如下图,下列描述中正确的是( )
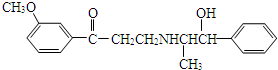
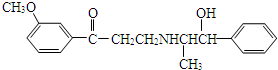
| A. | 该分子中含有酚羟基 | |
| B. | 该物质可以和浓氢溴酸发生取代反应 | |
| C. | 该物质可以和银氨溶液发生银镜反应 | |
| D. | 该分子苯环上的一氯取代物有6种 |
 .
.