题目内容
3.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 3.9gNa2O2晶体中阴阳离子总数为0.15NA | |
| B. | 1.0L1.0mo1•L-1的NaNO3水溶液中含有的氧原子数为3NA | |
| C. | 25℃时pH=13的Ba(OH)2溶液中含有OH一的数目为0.1NA | |
| D. | 1 mol的羟基与1 mol的氢氧根离子所含电子数均为9NA |
分析 A.过氧化钠中含有2个钠离子和1个过氧根离子,阴阳离子总数为3个;
B.NaNO3水溶液中有水存在;
C.Ba(OH)2溶液的体积不知,无法进行计算;
D.羟基含有9个电子,氢氧根离子含有10个电子.
解答 解:A.3.9gNa2O2晶体的物质的量为$\frac{3.9g}{78g/mol}$=0.05mol,故阴阳离子总数为0.05mol×3=0.15mol,即0.15NA个,故A正确;
B.NaNO3水溶液中有水存在,故1.0L1.0mo1•L-1的NaNO3水溶液中含有的氧原子数大于3NA,故B错误;
C.Ba(OH)2溶液的体积不知,故无法计算OH-的物质的量,故C错误;
D.1mol的羟基含有9mol电子,即9NA,1mol的氢氧根离子含有10mol电子,即10NA,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的应用,难度中等.B为易错点,注意溶液中有水存在.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.某净水剂可用化学式W(XY)Z2表示,已知W、Z处于同一周期,W是地壳中含量最多的金属元素,XY-能抑制水的电离,工业上常用熔融的W与X形成的化合物制取W的单质,下列说法正确的是( )
| A. | 原子半径:Z>W>X>Y | |
| B. | 最高正价:Z>X>W>Y | |
| C. | W(XY)Z2既能与稀硫酸反应,又能与氢氧化钠溶液反应 | |
| D. | 向W、Z形成的化合物的水溶液中滴加氨水,先生产白色沉淀,后沉淀溶解 |
14.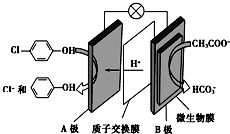 含乙酸钠和对氯酚(
含乙酸钠和对氯酚(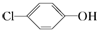 )的废水可以利用微生物电池除去,其原理如图所示:下列有关说法不正确的是( )
)的废水可以利用微生物电池除去,其原理如图所示:下列有关说法不正确的是( )
 含乙酸钠和对氯酚(
含乙酸钠和对氯酚( )的废水可以利用微生物电池除去,其原理如图所示:下列有关说法不正确的是( )
)的废水可以利用微生物电池除去,其原理如图所示:下列有关说法不正确的是( )| A. | 电极B是负极 | |
| B. | 质子从A极移向B极 | |
| C. | B极的电极反应式:CH3COO--8e-+2H2O=2CO2+7H+ | |
| D. | 处理后的废水pH降低 |
11.下列说法不正确的是( )
| A. | 234U,235U,238U是不同的核素,互称同位素 | |
| B. | 陶瓷,玻璃,水晶,红宝石都属于硅酸盐 | |
| C. | Na与熔融的KCl反应能制取K,但不能证明Na的金属性比K强 | |
| D. | 在400℃,800个大气压下,钠能与二氧化碳生成钻石和石墨,反应过程中CO2被还原 |
8.下列有关电解质溶液的说法中正确的是( )
| A. | 在蒸馏水中滴加浓H2SO4,KW不变 | |
| B. | 25℃时,在 c(H+)=$\sqrt{{K}_{W}}$的溶液中,大量存在Na+、S2-、NO3-、CO32-等离子 | |
| C. | 常温,0.1mol•L-1的NaHSO3溶液的pH=6,则c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) | |
| D. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
13.化学与社会、生活密切相关,下列有关说法中正确的是( )
| A. | 燃煤中加入CaO后可减少温室气体的排放量 | |
| B. | 糖类、油脂、蛋白质都是人类重要的营养物质,均属于天然高分子化合物 | |
| C. | 漂白粉、明矾均可用于饮用水处理,其化学原理相同 | |
| D. | 在全球每年被腐蚀的金属中,电化学腐蚀比化学腐蚀所占比例高 |
 .
.