题目内容
9.下列递变情况中,正确的是( )| A. | Si、P、S元素的最高正价依次降低 | |
| B. | Li、Na、K的原子半径依次增大 | |
| C. | C、O、N的原子半径依次减小 | |
| D. | Na、Mg、Al原子的最外层电子数依次减少 |
分析 A.Si、P、S元素的最高正价依次升高;
B.同主族元素从上到下元素原子半径依次增大;
C.同周期元素从左到右原子半径逐渐减小;
D.Na、Mg、Al位于同一周期,原子的最外层电子数依次增多.
解答 解:A.Si、P、S元素原子的最外层电子数依次为4、5、6、,元素的最高正价依次升高,故A错误;
B.同主族元素从上到下元素的原子半径依次增大,Li、Na、K的原子半径依次增大,故B正确;
C.同周期元素从左到右原子半径逐渐减小,则C、N、O的原子半径依次减小,故C错误;
D.Na、Mg、Al位于同一周期,原子的最外层电子数依次为1、2、3,最外层电子数依次增多,故D错误;
故选B.
点评 本题考查元素周期律的应用,题目难度不大,本题注意把握元素周期律的递变规律.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
20.从如表实验事实所得出的相应结论正确的是( )
| 实验事实 | 结论 | |
| ① | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| ② | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| ③ | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| ④ | 常温下白磷可自燃而氮气需在放电时才与氧气反应 | 非金属性:P>N |
| ⑤ | 某白色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液中一定有NH4+ |
| A. | ①②③ | B. | ①③⑤ | C. | ②③⑤ | D. | ③④⑤ |
17.表1是元素周期表的一部分( 注意:以下各空所涉及的元素填元素符号,不能用字母代替)
(1)C的元素符号为Al;
(2)C的离子的结构示意图 ,
,
(3)用电子式表示AE2的形成过程 G元素的最高价氧化物电子式
G元素的最高价氧化物电子式
(4)H元素的单质的电子式 ;H的氢化物的电子式
;H的氢化物的电子式
(5)A-H八种元素中(填化学式)
(a) 原 子 半径最大的元素是K,原子半径最小的元素是F.
(b)单质的还原性最强的元素是K,单质的氧化性最强的元素是F2
(c)酸性最强的最高价氧化物对应水化物是HClO4;
碱性最强的最高价氧化物对应水化物是KOH.
(6)请设计实验比较B、F的金属性强弱顺序.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O族 |
| 1 | ||||||||
| 2 | G | H | D | |||||
| 3 | B | C | E | |||||
| 4 | F | A | ||||||
(2)C的离子的结构示意图
 ,
,(3)用电子式表示AE2的形成过程
 G元素的最高价氧化物电子式
G元素的最高价氧化物电子式
(4)H元素的单质的电子式
 ;H的氢化物的电子式
;H的氢化物的电子式
(5)A-H八种元素中(填化学式)
(a) 原 子 半径最大的元素是K,原子半径最小的元素是F.
(b)单质的还原性最强的元素是K,单质的氧化性最强的元素是F2
(c)酸性最强的最高价氧化物对应水化物是HClO4;
碱性最强的最高价氧化物对应水化物是KOH.
(6)请设计实验比较B、F的金属性强弱顺序.
| 元素 | 实验设计 | 现象 | 结论 |
| B | 分别在两个盛有滴加酚酞的水的烧杯中加入形状相同的Na和K,观察现象 | K在反应中伴随轻微爆炸,钾比钠的反应更剧烈 | 金属性: K>Na |
| F |
14.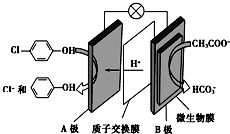 含乙酸钠和对氯酚(
含乙酸钠和对氯酚(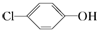 )的废水可以利用微生物电池除去,其原理如图所示:下列有关说法不正确的是( )
)的废水可以利用微生物电池除去,其原理如图所示:下列有关说法不正确的是( )
 含乙酸钠和对氯酚(
含乙酸钠和对氯酚( )的废水可以利用微生物电池除去,其原理如图所示:下列有关说法不正确的是( )
)的废水可以利用微生物电池除去,其原理如图所示:下列有关说法不正确的是( )| A. | 电极B是负极 | |
| B. | 质子从A极移向B极 | |
| C. | B极的电极反应式:CH3COO--8e-+2H2O=2CO2+7H+ | |
| D. | 处理后的废水pH降低 |
1.已知:弱酸HX(aq)与NaOH(aq)反应的中和热△H=-12.1kJ•mol-1; HCl(aq)与NaOH(aq)反应的中和热△H=-55.6kJ•mol-1.则HX在水溶液中电离的△H 等于( )
| A. | +43.5 | B. | -43.5 | ||
| C. | -67.7 | D. | +67.7(单位:kJ•mol-1) |
19.国家对食品、空气、药品安全问题越来越重视,下列说法中一定正确的是( )
| A. | 欧洲和北美洲的一些大城市上空二氧化氮浓度很高,其原因是这些地区硝酸工业发达 | |
| B. | 大气污染物中的二氧化硫能引起呼吸道疾病 | |
| C. | 天然的药物无任何毒副作用,可长期服用 | |
| D. | 长期食用二氧化硫含量超标的食品会破坏维生素B1,可通过服入碱性物质(如NaOH)的方法来消除二氧化硫中毒 |