题目内容
8.一定量Na2O2和NaHCO3,均匀混合物分成质量相等的甲乙两份.将甲投入100ml稀盐酸,固体完全溶解,收集到标准状况下干燥气体2.24L.再将生成气体全部导入装有乙的干燥管中,充分吸收后,收集到一种单质气体,标准状况下体积为2.016L.根据以上信息,下列有关推断不正确的是( )| A. | 甲乙两份混合物中均含Na2O20.16mol | |
| B. | 甲乙两份混合物中均含NaHCO30.02mol | |
| C. | 原混合物中Na2O2与NaHCO3物质的量之比无法确定 | |
| D. | 盐酸物质的量浓度可能为3.4mol/L |
分析 第一份发生反应①2Na2O2+4HCl=4NaCl+2H2O+O2、②NaHCO3+HCl=NaCl+H2O+CO2,生成气体为O2与CO2;将第一份生成的干燥气体,通入第二份Na2O2的NaHCO3的混合粉末,发生反应2Na2O2+2CO2=2Na2CO3+O2,根据气体物质的量差量利用差量法计算参加反应的二氧化碳、过氧化钠的物质的量,再根据二氧化碳是否过量进行计算.
解答 解:2.24L混合气体的物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,标况下2.016L的单质气体为氧气,2.016LO2的物质的量为:$\frac{2.016L}{22.4L/mol}$=0.09mol,则:
2Na2O2+2CO2=2Na2CO3+O2 气体物质的量减小△n
2 2 1
n m 0.1mol-0.09mol=0.01mol
所以,n=m=0.02mol,
由于CO2完全反应,则第一份生成CO2的为0.02mol,O2为0.1mol-0.02mol=0.08mol,则:
2Na2O2 +4HCl=4NaCl+2H2O+O2↑
0.16mol 0.32mol 0.08mol
NaHCO3+HCl=NaCl+H2O+CO2
0.02mol 0.02mol
所以消耗的HCl为:0.32mol+0.02mol=0.34mol,当氯化氢完全反应时,盐酸的物质的量浓度为:$\frac{0.34mol}{0.1L}$=3.4mol/L,故D正确;
每份中含有过氧化钠的物质的量为0.16mol,故A正确;
每份中含有碳酸氢钠为0.02mol,故B正确;
根据以上分析可知,能够确定碳酸氢钠、过氧化钠的物质的量之比,故C错误;
故选C.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的原理为解答关键,注意差量法在化学计算中的应用,试题侧重考查学生的分析、理解能力及化学计算能力.

| A. | 欧洲和北美洲的一些大城市上空二氧化氮浓度很高,其原因是这些地区硝酸工业发达 | |
| B. | 大气污染物中的二氧化硫能引起呼吸道疾病 | |
| C. | 天然的药物无任何毒副作用,可长期服用 | |
| D. | 长期食用二氧化硫含量超标的食品会破坏维生素B1,可通过服入碱性物质(如NaOH)的方法来消除二氧化硫中毒 |
| A. | 向烧碱溶液中加入铝:Al+2OH-=AlO2-+H2↑ | |
| B. | 用过量氨水吸收烟道气中的SO2:SO2+2NH3•H2O=SO32-+2NH4++H2O | |
| C. | 将饱和FeCl3溶液滴入废水中制取Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3↓+3H+ | |
| D. | 用Fe2+将饮用水中少量ClO2-还原成为Cl-:4Fe2++ClO2-+4H+=4Fe3++Cl-+2H2O |
| A. | 塑料奶瓶比玻璃奶瓶更有利于健康,且更加经久耐用 | |
| B. | 含乙醇、NaClO、H2O2等消毒液均可以将病毒氧化而达到消毒目的 | |
| C. | 喝补铁剂时,加服维生素C效果更好,原因是维生素C具有还原性 | |
| D. | 碳酸铝是一种应用很广的食品添加剂,可大量添加到馒头、面包等食品中 |
| A. | 燃煤中加入CaO后可减少温室气体的排放量 | |
| B. | 糖类、油脂、蛋白质都是人类重要的营养物质,均属于天然高分子化合物 | |
| C. | 漂白粉、明矾均可用于饮用水处理,其化学原理相同 | |
| D. | 在全球每年被腐蚀的金属中,电化学腐蚀比化学腐蚀所占比例高 |
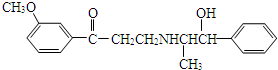
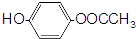
| A. | 该分子中含有酚羟基 | |
| B. | 该物质可以和浓氢溴酸发生取代反应 | |
| C. | 该物质可以和银氨溶液发生银镜反应 | |
| D. | 该分子苯环上的一氯取代物有6种 |
| A. | 78gNa2O2与62gNa2O中所含阴离子数目都是NA | |
| B. | 常温常压下,NA个Cl2通入水中,转移电子数为NA | |
| C. | 电解精炼铜时,若阴极得到2NA个电子,则阳极质量减少64g | |
| D. | 5.6g铁粉与足量硫粉充分反应,转移电子数为0.3NA |
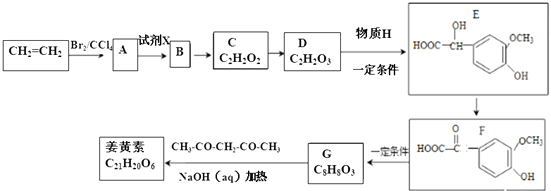
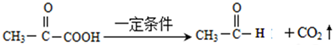

 .
.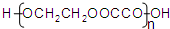 .
. .
.