题目内容
12.实验室从含碘废液(含有H2O、CCl4、I2、I-等)中回收碘,操作过程如下:
(1)向废液中加入Na2SO3 溶液,发生“还原”反应的离子方程式为SO32-+I2+H2O=2I-+SO42-+2H+.
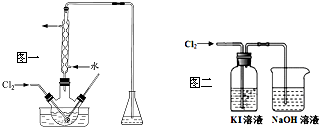
(2)“氧化”操作在三颈烧瓶中进行(如图一),将溶液用盐酸调至pH约为2,缓慢通入Cl2.实验用水浴控制在40℃左右的较低温度下进行的原因是使氯气在溶液中有较大的溶解度(或防止I2升华或防止I2进一步被氧化).
(3)某研究小组用图二装置对Cl2与KI溶液的反应进行探究,发现通入Cl2一段时间后,KI溶液变为黄色,继续通入Cl2,则溶液黄色变浅,最后变为无色.研究小组对所得无色溶液中碘元素的存在形态提出了以下假设:
假设一:没有I2形态;假设二:没有I-形态;假设三:有IO3-形态.
①请设计实验证明假设一成立(试剂自选).
| 实验操作 | 预期现象 | 结论 |
| 假设一成立 |
(4)该研究小组还进行了对加碘盐中KIO3含量测定的如下实验:
①准确称取加碘盐m g于烧杯中,加入适量蒸馏水和过量的KI,再滴入适量的稀硫酸,充分反应,将所得混合液配成250.00mL待测溶液.移取25.00mL待测溶液于锥形瓶中,加几滴淀粉试液,用c mol•L-1 Na2S2O3标准液滴定至终点,重复3次,测得平均值为V mL.
已知:IO3-+5I-+6H+=3H2O+3I2,I2+2S2O32-=2I-+S4O62-.测定时,判断达到滴定终点的现象为溶液由蓝色变为无色,且半分钟不变色.由测定数据可求得该样品中含KIO3的质量分数为$\frac{21.4CV}{6m}$%(用含m、c、V的代数式表示,Mr(KIO3)=214 ).
②在滴定操作正确无误的情况下,用此种测定方法测得的结果往往偏高,其原因是受空气的影响,请用离子方程式表示产生这一影响的原因4I-+O2+4H+=2I2+2H2O.
分析 (1)亚硫酸根离子具有强的还原性能够还原单质碘;
(2)温度越高,氯气溶解度越小;
(3)①单质遇到淀粉变蓝色;
②若生成碘酸根离子,则发生氯气氧化碘的反应,依据得失电子守恒、原子个数守恒写出反应方程式;
(4)①反应结束时,碘反应完全,滴加最后一滴液体时溶液由蓝色变为无色且半分钟内不变色,说明到达滴定终点;
根据关系式IO3-~3I2~6S2O32-进行计算;
②实验测得结果偏高,说明滴定消耗的Na2S2O3标准液体积偏高,溶液中碘的含量偏高,应是生成的碘离子被氧气氧化为碘所致.
解答 解:(1)亚硫酸根离子与碘发生氧化还原反应,离子方程式:SO32-+I2+H2O=2I-+SO42-+2H+;
故答案为:SO32-+I2+H2O=2I-+SO42-+2H+;
(2)温度越高,氯气溶解度越小,为增加氯气溶解的量,应控制在低温条件下,
故答案为:使氯气在溶液中有较大的溶解度(或防止I2升华或防止I2进一步被氧化);
(3)①碘单质遇到淀粉变蓝色,所以向所得无色溶液中加入淀粉试液,若不变蓝色,说明不存在碘;
故答案为:
| 实验操作 | 预期现象 |
| 取所得无色溶液,向其中加入淀粉试液 | 溶液不变蓝 |
故答案为:I2+5Cl2+6H2O=10Cl-+2IO3-+12H+;
(4)①碘遇淀粉变蓝色,反应结束时,碘反应完全,滴加最后一滴Na2S2O3标准液时溶液由蓝色变为无色且半分钟内不变色,说明到达滴定终点;
令样品中IO3-的质量分数为a,则:
KIO3~3I2~6S2O32-
214 6
ma CV×10-3,
解得:a=$\frac{21.4CV}{6m}$%;
故答案为:溶液由蓝色变为无色且半分钟内不变色;=$\frac{21.4CV}{6m}$%;
②实验测得结果偏高,说明滴定消耗的Na2S2O3标准液体积偏高,溶液中碘的含量偏高,应是生成的碘离子被氧气氧化为碘,同时生成水,反应离子方程式为4I-+O2+4H+=2I2+2H2O,
故答案为:4I-+O2+4H+=2I2+2H2O;
点评 本题考查了氧化还原反应方程式书写、氧化还原滴定,熟悉氧化还原反应规律及物质的性质是解题关键,题目难度中等.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目
3.短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子;Y元素原子的M电子层上的电子数是它K层和L层电子总数的一半;Z元素原子的L电子层上的电子数比Y元素原子的L电子层上电子数少2个.则这三种元素所组成的化合物的化学式不可能是( )
| A. | X2YZ3 | B. | X2YZ4 | C. | X3YZ4 | D. | X4Y2Y7 |
20.下列叙述正确的是(NA表示阿伏加德罗常数)( )
| A. | 0.1 mol•L-1NH4A溶液显中性,说明HA为弱电解质 | |
| B. | 1 mol FeI2与足量氯气反应时转移的电子数为2NA | |
| C. | Na、Al、Fe三种单质在一定条件下都能与水反应生成H2和相应的碱 | |
| D. | 水电离出的c(OH-)=1×10-13mol•L-1的溶液中,可能大量存在:Na+、K+、Cl-、HCO3- |
7.化学在生产和日常生活中有着重要的作用.下列说法正确的是( )
| A. | 新型材料聚酯纤维、光导纤维都属于有机高分子材料 | |
| B. | “地沟油”不能食用,但经加工处理后,可用来制造肥皂和生物柴油 | |
| C. | 糖类、油脂、蛋白质等都具有固定的熔沸点 | |
| D. | 可用热的饱和碳酸钠溶液除去金属表面的矿物油(如机油、润滑油等) |
17.下列实验方案不能达到实验目的是( )
| 实验目的 | 实验方案 | |
| A | 检验亚硫酸钠固体是否变质 | 取少量固体于试管中,加水溶解,滴加硝酸钡溶液产生白色沉淀,滴加盐酸,观察沉淀是否溶解 |
| B | 测定镁铝混合物中铝的质量分数 | 取mg混合物,加入足量NaOH溶液,充分反应后,过滤、洗涤、烘干,剩余土体ag,计算 |
| C | 检验某无色溶液中说法存在NH4+ | 取少量无色溶液于试管中,滴加NaOH溶液、加热.用湿润的红色石蕊试纸检验生成的气体,观察试纸是否变蓝 |
| D | 除去MgCl2溶液中的少量FeCl3 | 像溶液中加入足量Mg(OH)2分末,充分搅拌、静置、过滤 |
| A. | A | B. | B | C. | C | D. | D |
4.能大量共存于同一溶液中,且当加入另一种强电解质使水电离出的c(H+)=1×10-13mol•L-1时又一定能发生反应的离子组是( )
| A. | Fe2+、Na+、SCN-、Cl- | B. | Ca2+、Cu2+、NO3-、SO32- | ||
| C. | Na+、Ba2+、Cl-、HCO3- | D. | Al3+、Na+、SO42-、NO3- |
 某有机物(结构如图)的一种同分异构体同时满足下列条件:
某有机物(结构如图)的一种同分异构体同时满足下列条件: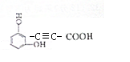 .
. 或
或
 .写出该两步反应所需的试剂及条件液溴、溴化铁作催化剂、溴、光照
.写出该两步反应所需的试剂及条件液溴、溴化铁作催化剂、溴、光照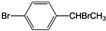 与足量氢氧化钠溶液共热得到A,A在酸性条件下遇FeCl3溶液不显色.
与足量氢氧化钠溶液共热得到A,A在酸性条件下遇FeCl3溶液不显色. .
.