题目内容
20.工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)?Si(s)+4HCl(g);△H=+Q kJ•mol-1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )| A. | 反应过程中,若增大压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ | |
| C. | 反应4 min时,若HCl浓度为0.12 mol•L-1,则H2反应速率为0.03 mol•L-1•min-1 | |
| D. | 当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol•L-1的NaOH溶液恰好反应 |
分析 A.增大平衡向气体体积减小的方向移动,据此判断;
B.该反应为可逆反应,1molSiCl4不能完全转化,结合热化学方程式判断;
C.根据v=$\frac{△c}{△t}$计算v(HCl),利用速率之比等于化学计量数之比计算判断;
D.根据反应吸收的热量计算生成的HCl的物质的量,据此判断.
解答 解:A.从方程式可以看出,反应物气体的计量数之和小于生成物气体的计量数之和,则增大压强,平衡向逆反应方向移动,SiCl4的转化率减小,故A错误;
B.该反应为可逆反应,1molSiCl4不能完全转化,达平衡时,吸收热量小于QkJ,故B错误;
C.反应至4min时,若HCl浓度为0.12mol/L,则v(HCl)=$\frac{0.12mol/L}{4min}$=0.03mol/(L•min),根据反应速率之比等于化学计量数之比,则v(H2)=$\frac{1}{2}$×v(HCl)=$\frac{1}{2}$×0.03mol/(L•min)=0.015mol/(L•min),故C错误;
D.由方程式可知,当反应吸收热量为0.025QkJ时,生成HCl的物质的量为:$\frac{0.025QkJ}{QkJ/mol}$=0.1mol,100mL1mol/L的NaOH的物质的量为0.1L×1mol/L=0.1mol,二者物质的量相等,恰好反应,故D正确;
故选D.
点评 本题考查较为综合,涉及反应热的计算、化学反应速率、化学平衡等问题,题目难度中等,注意反应的可逆性.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
10.反应2S02(g)+O2?2SO3(g)△H<0,下列措施能提高S02转化率的是( )
| A. | 增大S02的浓度 | B. | 提高O2与SO2的体积比 | ||
| C. | 减小压强 | D. | 升高温度 |
8.金属及塑料制品表面镀铬不仅美观还可提高金属制品抗腐蚀性能,电镀废水中六价铬具有高毒性,必须经处理后才能排放.
(1)常见镀铬液由重铬酸(H2Cr2O7)和催化剂硫酸组成.
①镀铬液在水溶液中存在如下平衡:Cr2O72-+H2O?2CrO42-+2H+该反应平衡常数表达式为K=$\frac{{c}^{2}(Cr{O}_{4}^{2-})•{c}^{2}({H}^{+})}{c(C{r}_{2}{O}_{7}^{2-})}$.
②镀铬时由CrO42-放电产生铬镀层.阴极的电极反应式为CrO42-+8H++6e-=Cr+4H2O.
③ABS塑料表面经处理后也可在其表面镀铬,ABS塑料的结构简式如下:
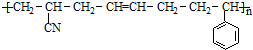 ,合成该聚合物的三种单体为:CH2=CHCN、CH2=CH-CH=CH2和
,合成该聚合物的三种单体为:CH2=CHCN、CH2=CH-CH=CH2和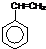 (写结构简式).
(写结构简式).
(2)工业上处理含铬废水有钡盐法、电解还原法等.
Ⅰ.钡盐法处理含铬废水主要流程为:
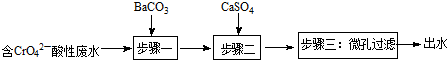
已知:
①步骤一发生的反应之一为:CrO42-+BaCO3═BaCrO4+CO32-,可推知:Ksp(BaCrO4)<Ksp(BaCO3)(选填:“>”或“<”);
②步骤二的目的是除去废水中Ba2+.
Ⅱ.电解法处理含六价铬(Cr2O72-和CrO42-)的强酸性废水,其原理如图所示.
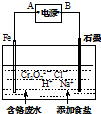
③电解一段时间后随着溶液pH的升高,便有Fe(OH)3和Cr(OH)3沉淀生成.图中A为电源正极(选填:“正”或“负”);
④阴极产生的气体为H2(写化学式).
⑤常温时Ksp[Cr(OH)3]=6.0×10-31,当废水的pH=7.0时,溶液中c(Cr3+)=6.0×10-10mol•L-1.
(1)常见镀铬液由重铬酸(H2Cr2O7)和催化剂硫酸组成.
①镀铬液在水溶液中存在如下平衡:Cr2O72-+H2O?2CrO42-+2H+该反应平衡常数表达式为K=$\frac{{c}^{2}(Cr{O}_{4}^{2-})•{c}^{2}({H}^{+})}{c(C{r}_{2}{O}_{7}^{2-})}$.
②镀铬时由CrO42-放电产生铬镀层.阴极的电极反应式为CrO42-+8H++6e-=Cr+4H2O.
③ABS塑料表面经处理后也可在其表面镀铬,ABS塑料的结构简式如下:
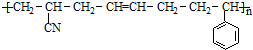 ,合成该聚合物的三种单体为:CH2=CHCN、CH2=CH-CH=CH2和
,合成该聚合物的三种单体为:CH2=CHCN、CH2=CH-CH=CH2和 (写结构简式).
(写结构简式).(2)工业上处理含铬废水有钡盐法、电解还原法等.
Ⅰ.钡盐法处理含铬废水主要流程为:

已知:
| 物质 | BaCO3 | CaSO4 | BaSO4 |
| Ksp | 8.1×10-9 | 9×10-6 | 1.1×10-10 |
②步骤二的目的是除去废水中Ba2+.
Ⅱ.电解法处理含六价铬(Cr2O72-和CrO42-)的强酸性废水,其原理如图所示.

③电解一段时间后随着溶液pH的升高,便有Fe(OH)3和Cr(OH)3沉淀生成.图中A为电源正极(选填:“正”或“负”);
④阴极产生的气体为H2(写化学式).
⑤常温时Ksp[Cr(OH)3]=6.0×10-31,当废水的pH=7.0时,溶液中c(Cr3+)=6.0×10-10mol•L-1.
5.下列对有机物结构或性质的描述,错误的是( )
| A. | 一定条件下,Cl2 可在甲苯的苯环或侧链上发生取代反应? | |
| B. | 苯酚钠溶液中通入CO2 生成苯酚,则碳酸的酸性比苯酚弱? | |
| C. | 乙烷和丙烯混合气体的物质的量共1 mol,完全燃烧生成3 mol H2O | |
| D. | 光照下,2,2-二甲基丙烷与Br2 反应其一溴取代物只有一种 |
12.取代反应是有机化学中的一类重要的反应,下列过程中发生取代反应的是( )
| A. | 乙烯通入溴的四氯化碳溶液发生反应 | |
| B. | 苯与浓硝酸、浓硫酸混和后加热至50℃~60℃发生反应 | |
| C. | 在苯中滴入溴水,振荡后溴水层褪色 | |
| D. | 乙烯通入酸性高锰酸钾溶液后溶液褪色 |
9.下列离子方程式中,正确的是( )
| A. | 稀硫酸与氢氧化钡溶液反应:Ba2-+SO42-═BaSO4↓ | |
| B. | 氧化铜与稀硫酸混合:CuO+2H+═Cu2++H2O | |
| C. | 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+OH-═Cu(OH)2↓+SO42- | |
| D. | 氯化铝溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
10.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,11.2 L水中含有分子的数目为0.5NA | |
| B. | 1 mol Cl2与足量的NaOH溶液反应,转移的电子数为1NA | |
| C. | 100 mL 0.2 mol•L-1的FeCl3溶液中,含Fe3+数为0.02NA | |
| D. | 常温常压下,22.4 L的NO2和CO2混合气体含有2NA个O原子 |