题目内容
12.取代反应是有机化学中的一类重要的反应,下列过程中发生取代反应的是( )| A. | 乙烯通入溴的四氯化碳溶液发生反应 | |
| B. | 苯与浓硝酸、浓硫酸混和后加热至50℃~60℃发生反应 | |
| C. | 在苯中滴入溴水,振荡后溴水层褪色 | |
| D. | 乙烯通入酸性高锰酸钾溶液后溶液褪色 |
分析 A、乙烯中的双键断裂,每个碳原子上结合一个溴原子生成1,2-二溴乙烯;
B、苯的氢原子被硝基所代替生成硝基苯;
C、苯能萃取溴水中的溴,所以水层接近无色,是萃取.
D、高锰酸钾和乙烯发生了氧化还原反应而使高锰酸钾褪色.
解答 解:A、乙烯中的双键断裂,每个碳原子上结合一个溴原子生成1,2-二溴乙烯,所以属于加成反应,故A错误;
B、苯与浓硝酸、浓硫酸混和后加热至50℃~60℃后,苯的氢原子被硝基所代替生成硝基苯,属于取代反应,故B正确;
C、苯能萃取溴水中的溴,所以水层接近无色,不是取代反应是萃取,故C错误.
D、乙烯使酸性高锰酸钾溶液褪色,原因是高锰酸钾和乙烯发生了氧化还原反应而使高锰酸钾褪色,故D错误;
故选B.
点评 本题主要考查了取代反应的判断,难度不大,注意:乙烯含有碳碳双键,所以性质较活泼,能被酸性高锰酸钾溶液氧化成二氧化碳.

练习册系列答案
相关题目
2.下列比较正确的是( )
| A. | 电离能:N>O>F | B. | 物质熔点:H2O>I2>CO2 | ||
| C. | 共价键的极性:C-F>C-O>C-N | D. | 氢化物的稳定性:HBr>HCl>HF |
3.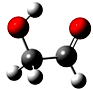 迄今为止科学家在星云中已发现180多种星际分子,寓意着地球上的生命或起源于太空.近年来发现的星际分子乙醇醛球棍模型如图,有关乙醇醛说法错误的是( )
迄今为止科学家在星云中已发现180多种星际分子,寓意着地球上的生命或起源于太空.近年来发现的星际分子乙醇醛球棍模型如图,有关乙醇醛说法错误的是( )
 迄今为止科学家在星云中已发现180多种星际分子,寓意着地球上的生命或起源于太空.近年来发现的星际分子乙醇醛球棍模型如图,有关乙醇醛说法错误的是( )
迄今为止科学家在星云中已发现180多种星际分子,寓意着地球上的生命或起源于太空.近年来发现的星际分子乙醇醛球棍模型如图,有关乙醇醛说法错误的是( )| A. | 有2种含氧官能团 | B. | 能发生银镜反应 | ||
| C. | 与葡萄糖互为同系物 | D. | 与乙酸互为同分异构体 |
20.工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)?Si(s)+4HCl(g);△H=+Q kJ•mol-1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ | |
| C. | 反应4 min时,若HCl浓度为0.12 mol•L-1,则H2反应速率为0.03 mol•L-1•min-1 | |
| D. | 当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol•L-1的NaOH溶液恰好反应 |
7.欲除去下列物质中混入的少量杂质(括号内物质为杂质),不能达到目的是( )
| A. | 乙酸乙酯(乙酸):加饱和Na2CO3 溶液,充分振荡静置后,分液 | |
| B. | 乙醇(水):加入新制生石灰,蒸馏 | |
| C. | 乙酸(乙醇):加入金属钠,蒸馏 | |
| D. | 苯(液溴):加入NaOH溶液,分液 |
17.随着卤素原子半径的增加,下列递变规律正确的是( )
| A. | 单质的熔沸点逐渐降低 | B. | 卤素离子的还原性逐渐增强 | ||
| C. | 最高正化合价逐渐增大 | D. | 单质的氧化性逐渐增强 |
4.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下面是八种短周期元素的相关信息(已知Be的原子半径为0.089nm)
F原子中无中子,G最高正价为负价绝对值相等,且最外层电子数是次外层的二倍,H元素单质熔色反应呈黄色.
(1)B元素在元素周期表中的位置第三周期ⅢA族.B形成的简单离子的结构示意图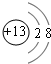 .
.
(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是HClO4(填化学式).
(3)用电子式表示C,H形成化合物的过程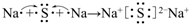 .
.
(4)H,E形成原子个数比为1:1的化合物中所含化学键类型为离子键、共价键.
(5)F与G形成的最简单的化合物的电子式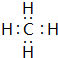 .
.
(6)E的氢化物比C的氢化物的熔沸点高的原因是水分子之间存在氢键,硫化氢分子之间为范德华力,氢键比范德华力更强.
(7)A,B,C,E所形成的简单离子半径由大到小的顺序为S2->O2->Mg2+>Al3+.
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
(1)B元素在元素周期表中的位置第三周期ⅢA族.B形成的简单离子的结构示意图
 .
.(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是HClO4(填化学式).
(3)用电子式表示C,H形成化合物的过程
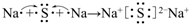 .
.(4)H,E形成原子个数比为1:1的化合物中所含化学键类型为离子键、共价键.
(5)F与G形成的最简单的化合物的电子式
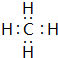 .
.(6)E的氢化物比C的氢化物的熔沸点高的原因是水分子之间存在氢键,硫化氢分子之间为范德华力,氢键比范德华力更强.
(7)A,B,C,E所形成的简单离子半径由大到小的顺序为S2->O2->Mg2+>Al3+.
1.下列叙述能证明某物质是弱电解质的是( )
| A. | 水溶液的导电能力很弱 | |
| B. | 溶液中电离出的离子与未电离的分子共存 | |
| C. | 熔化时不导电 | |
| D. | 不是离子化合物而是共价化合物 |
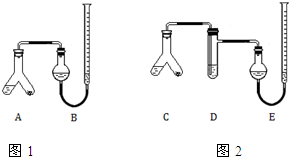 某实验小组分别用图1、2装置测定某种钙片中碳酸钙的含量,夹持装置已略去.
某实验小组分别用图1、2装置测定某种钙片中碳酸钙的含量,夹持装置已略去.