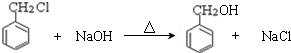
题目内容
5.下列对有机物结构或性质的描述,错误的是( )| A. | 一定条件下,Cl2 可在甲苯的苯环或侧链上发生取代反应? | |
| B. | 苯酚钠溶液中通入CO2 生成苯酚,则碳酸的酸性比苯酚弱? | |
| C. | 乙烷和丙烯混合气体的物质的量共1 mol,完全燃烧生成3 mol H2O | |
| D. | 光照下,2,2-二甲基丙烷与Br2 反应其一溴取代物只有一种 |
分析 A.光照条件下,氯气和甲苯侧链上氢原子发生取代反应,在催化剂作用下,氯气和甲苯苯环H原子发生取代反应;
B.强酸能和弱酸盐反应生成弱酸;
C.乙烷和丙烯的每个分子中都含有6个H原子,根据H原子守恒判断生成水的物质的量;
D.2,2-二甲基丙烷只有一种氢原子,有几种氢原子,其一溴代物就有几种.
解答 解:A.光照条件下,氯气和甲苯侧链上氢原子发生取代反应,在催化剂作用下,氯气和甲苯苯环H原子发生取代反应,所以一定条件下,Cl2 可在甲苯的苯环或侧链上发生取代反应,故A正确;
B.强酸能和弱酸盐反应生成弱酸,苯酚钠溶液中通入CO2 生成苯酚,说明碳酸的酸性比苯酚强,故B错误;
C.乙烷和丙烯的每个分子中都含有6个H原子,根据H原子守得,1 mol乙烷和丙烯混合物,完全燃烧生成3 mol H2O,故C正确;
D.2,2-二甲基丙烷只有一种氢原子,有几种氢原子,其一溴代物就有几种,所以光照下,2,2-二甲基丙烷与Br2 反应其一溴取代物只有一种,故D正确;
故选B.
点评 本题考查同分异构体种类判断、酸性强弱比较、根据方程式进行计算等知识点,综合性较强,注意反应条件不同其产物可能不同,易错选项是C,利用原子守恒解答即可,题目难度不大.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
15.下列各组混合物,只要总质量一定,无论按何种比例混合,完全燃烧后生成C02和H2O的质量都相等的是( )
| A. | C2H2、C2H4 | B. | C6H6,C6H6O | C. | C3H8,C3H6 | D. | CH2O、C2H4O2 |
13.下表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素符号:①N,⑥Si,⑦S.
(2)在①-(12)元素中,金属性最强的元素是K,非金属性最强的元素是F,最不活泼的元素是Ar.(均填元素符号)
(3)元素⑦与元素⑧相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是BD.
A.常温下⑦的单质和⑧的单质状态不同
B.⑧的氢化物比⑦的氢化物稳定
C.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
D.⑧的最高价氧化物的水化物的酸性比⑦的最高价氧化物的水化物的酸性强.
| 族 周期 | IA | ⅡA | ⅢA | IVA | VA | VIA | VⅡA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | (11) | (12) |
(2)在①-(12)元素中,金属性最强的元素是K,非金属性最强的元素是F,最不活泼的元素是Ar.(均填元素符号)
(3)元素⑦与元素⑧相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是BD.
A.常温下⑦的单质和⑧的单质状态不同
B.⑧的氢化物比⑦的氢化物稳定
C.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
D.⑧的最高价氧化物的水化物的酸性比⑦的最高价氧化物的水化物的酸性强.
20.工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)?Si(s)+4HCl(g);△H=+Q kJ•mol-1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ | |
| C. | 反应4 min时,若HCl浓度为0.12 mol•L-1,则H2反应速率为0.03 mol•L-1•min-1 | |
| D. | 当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol•L-1的NaOH溶液恰好反应 |
10.下列说法中,错误的是( )
| A. | 任何化学反应都伴随物质变化和能量变化 | |
| B. | 元素的气态氢化物的水溶液酸性越强,该元素的非金属性就越强 | |
| C. | 有些放热反应也需要加热才能发生 | |
| D. | 构成宏观物质的微观粒子之间的相互作用有多种形式,如离子键、共价键等 |
17.随着卤素原子半径的增加,下列递变规律正确的是( )
| A. | 单质的熔沸点逐渐降低 | B. | 卤素离子的还原性逐渐增强 | ||
| C. | 最高正化合价逐渐增大 | D. | 单质的氧化性逐渐增强 |
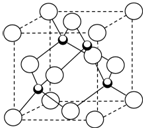 原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.
原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.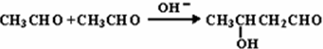
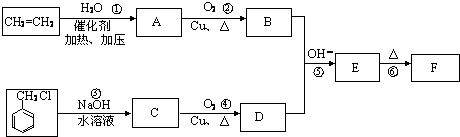
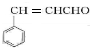 .E中含氧官能团的名称为醛基、羟基.
.E中含氧官能团的名称为醛基、羟基.