题目内容
8.金属及塑料制品表面镀铬不仅美观还可提高金属制品抗腐蚀性能,电镀废水中六价铬具有高毒性,必须经处理后才能排放.(1)常见镀铬液由重铬酸(H2Cr2O7)和催化剂硫酸组成.
①镀铬液在水溶液中存在如下平衡:Cr2O72-+H2O?2CrO42-+2H+该反应平衡常数表达式为K=$\frac{{c}^{2}(Cr{O}_{4}^{2-})•{c}^{2}({H}^{+})}{c(C{r}_{2}{O}_{7}^{2-})}$.
②镀铬时由CrO42-放电产生铬镀层.阴极的电极反应式为CrO42-+8H++6e-=Cr+4H2O.
③ABS塑料表面经处理后也可在其表面镀铬,ABS塑料的结构简式如下:
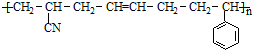 ,合成该聚合物的三种单体为:CH2=CHCN、CH2=CH-CH=CH2和
,合成该聚合物的三种单体为:CH2=CHCN、CH2=CH-CH=CH2和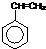 (写结构简式).
(写结构简式).(2)工业上处理含铬废水有钡盐法、电解还原法等.
Ⅰ.钡盐法处理含铬废水主要流程为:
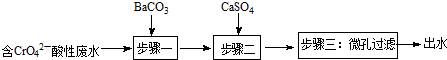
已知:
| 物质 | BaCO3 | CaSO4 | BaSO4 |
| Ksp | 8.1×10-9 | 9×10-6 | 1.1×10-10 |
②步骤二的目的是除去废水中Ba2+.
Ⅱ.电解法处理含六价铬(Cr2O72-和CrO42-)的强酸性废水,其原理如图所示.

③电解一段时间后随着溶液pH的升高,便有Fe(OH)3和Cr(OH)3沉淀生成.图中A为电源正极(选填:“正”或“负”);
④阴极产生的气体为H2(写化学式).
⑤常温时Ksp[Cr(OH)3]=6.0×10-31,当废水的pH=7.0时,溶液中c(Cr3+)=6.0×10-10mol•L-1.
分析 (1)①化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,水不需要写出,据此书写;
②阴极发生还原反应,电极反应式为CrO42-+8H++6e-=Cr+4H2O;
③首先要根据高聚物的结构简式判断高聚物是加聚产物还是缩聚产物,然后根据推断单体的方法作出判断;
(2)①反应能发生说明BaCrO4小于BaCO3的溶度积;
②加入硫酸钙是为了生成难溶的硫酸钡,从而除去体系中的钡离子;
③便有Fe(OH)3和Cr(OH)3沉淀生成,说明单质铁放电,生成亚铁离子,与Cr2O72-和CrO42-发生氧化还原,所以铁为阳极,则A为正极;
④阴极是氢离子放电生成氢气;
⑤根据Ksp[Cr(OH)3]=c(Cr3+)•c3(OH-)=6.0×10-31,而溶液的pH=7.0时,所以c(OH-)=10-7mol/L,由此求出溶液中c(Cr3+).
解答 解:(1)①根据化学平衡常数的定义,可知Cr2O72-(aq)+H2O(l)?2CrO42-(aq)+2H+(aq)的平衡常数K=$\frac{{c}^{2}(Cr{O}_{4}^{2-})•{c}^{2}({H}^{+})}{c(C{r}_{2}{O}_{7}^{2-})}$,故答案为:$\frac{{c}^{2}(Cr{O}_{4}^{2-})•{c}^{2}({H}^{+})}{c(C{r}_{2}{O}_{7}^{2-})}$;
②阴极发生还原反应,电极反应式为CrO42-+8H++6e-=Cr+4H2O,故答案为:CrO42-+8H++6e-=Cr+4H2O;
③该高聚物的形成过程属于加聚反应,加聚反应是由不饱和单体(如碳碳双键,碳碳叁键以及碳氧双键等)聚合高分子的反应,其产物只有一种高分子化合物,凡链节中主碳链为6个碳原子,其规律是“见双键,四个碳,无双键,两个碳”画线断开,然后将半键闭合,即将单双键互换,直接合成该高聚物的物质为:CH2=CH-CN、CH2=CH-CH=CH2、 ,故答案为:CH2=CHCN;CH2=CH-CH=CH2;
,故答案为:CH2=CHCN;CH2=CH-CH=CH2; ;
;
(2)①反应能发生说明BaCrO4小于BaCO3的溶度积,所以Ksp(BaCrO4)<Ksp(BaCO3),故答案为:<;
②加入硫酸钙是为了生成难溶的硫酸钡,从而除去体系中的钡离子,故答案为:除去废水中Ba2+;
③便有Fe(OH)3和Cr(OH)3沉淀生成,说明单质铁放电,生成亚铁离子,与Cr2O72-和CrO42-发生氧化还原,所以铁为阳极,则A为正极,故答案为:正;
④阴极是氢离子放电生成氢气,故答案为:H2;
⑤c(Cr3+)=$\frac{Ksp[Cr(OH)_{3}]}{{c}^{3}(O{H}^{-})}$=$\frac{6.0×1{0}^{-31}}{(1{0}^{-7})^{3}}$=6.0×10-10mol•L-1,故答案为:6.0×10-10.
点评 本题考查了物质的分离提纯流程,主要考查了操作流程分析溶度积常数的计算、电极反应式的书写等,题目难度中等,侧重于考查学生分析问题、解决问题能力和计算能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 打开啤酒瓶后,瓶中立即泛起大量泡沫 | |
| B. | 工业制取金属钾:Na(l)+KCl(l)?NaCl(l)+K(g),选取适宜的温度,使K成蒸汽从反应混合物中分离出来 | |
| C. | 在溴水中存在如下平衡:Br2+H2O?HBr+HBrO,当加入NaOH溶液后,颜色变浅 | |
| D. | 对于2HI(g)?H2(g)+I2(g)平衡体系增加压强使颜色变深 |
| A. | CuSO4溶液 | B. | NaOH溶液 | C. | Fe2O3 | D. | 浓硫酸 |
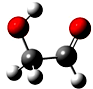 迄今为止科学家在星云中已发现180多种星际分子,寓意着地球上的生命或起源于太空.近年来发现的星际分子乙醇醛球棍模型如图,有关乙醇醛说法错误的是( )
迄今为止科学家在星云中已发现180多种星际分子,寓意着地球上的生命或起源于太空.近年来发现的星际分子乙醇醛球棍模型如图,有关乙醇醛说法错误的是( )| A. | 有2种含氧官能团 | B. | 能发生银镜反应 | ||
| C. | 与葡萄糖互为同系物 | D. | 与乙酸互为同分异构体 |
| 族 周期 | IA | ⅡA | ⅢA | IVA | VA | VIA | VⅡA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | (11) | (12) |
(2)在①-(12)元素中,金属性最强的元素是K,非金属性最强的元素是F,最不活泼的元素是Ar.(均填元素符号)
(3)元素⑦与元素⑧相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是BD.
A.常温下⑦的单质和⑧的单质状态不同
B.⑧的氢化物比⑦的氢化物稳定
C.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
D.⑧的最高价氧化物的水化物的酸性比⑦的最高价氧化物的水化物的酸性强.
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ | |
| C. | 反应4 min时,若HCl浓度为0.12 mol•L-1,则H2反应速率为0.03 mol•L-1•min-1 | |
| D. | 当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol•L-1的NaOH溶液恰好反应 |
| A. | 单质的熔沸点逐渐降低 | B. | 卤素离子的还原性逐渐增强 | ||
| C. | 最高正化合价逐渐增大 | D. | 单质的氧化性逐渐增强 |
(1)水溶液中X+Y2+═X2++Y;
(2)Z+2H2O(冷水)═Z(OH)2+H2↑;
(3)M、N为电极,与N盐溶液组成原电池,M电极反应为M-2e-═M2+;
(4)Y可以溶于稀硫酸中,M不被稀硫酸氧化.
则这五种金属的活动性由弱到强的顺序是( )
| A. | M<N<Y<X<Z | B. | N<M<X<Y<Z | C. | N<M<Y<X<Z | D. | X<Z<N<M<Y |