题目内容
9.下列离子方程式中,正确的是( )| A. | 稀硫酸与氢氧化钡溶液反应:Ba2-+SO42-═BaSO4↓ | |
| B. | 氧化铜与稀硫酸混合:CuO+2H+═Cu2++H2O | |
| C. | 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+OH-═Cu(OH)2↓+SO42- | |
| D. | 氯化铝溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
分析 A.漏掉氢氧根离子与氢离子的反应;
B.氧化铜与稀硫酸混合,反应生成硫酸铜和水;
C.硫酸铜为可溶性盐,拆成离子;
D.氯化铝溶液中加入过量氨水,反应生成氢氧化铝.
解答 解:A.稀硫酸与氢氧化钡溶液反应,离子方程式:2H++2OH-+Ba2-+SO42-═BaSO4↓+2H2O,故A错误;
B.氧化铜与稀硫酸混合,离子方程式:CuO+2H+═Cu2++H2O,故B正确;
C.硫酸铜溶液与氢氧化钠溶液混合,离子方程式:Cu2++2OH-═Cu(OH)2↓,故C错误;
D.氯化铝溶液中加入过量氨水,离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故D错误;
故选:B.
点评 本题考查了离子方程式的正误判断,熟悉离子方程式书写方法,明确反应实质是解题关键,注意离子反应须遵循客观事实.

练习册系列答案
相关题目
19.工业上可用组成为K2O•M2O3•2RO2•nH2O的无机材料纯化制取氢气.元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则常温下,不能与M单质发生反应的是( )
| A. | CuSO4溶液 | B. | NaOH溶液 | C. | Fe2O3 | D. | 浓硫酸 |
20.工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)?Si(s)+4HCl(g);△H=+Q kJ•mol-1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ | |
| C. | 反应4 min时,若HCl浓度为0.12 mol•L-1,则H2反应速率为0.03 mol•L-1•min-1 | |
| D. | 当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol•L-1的NaOH溶液恰好反应 |
17.随着卤素原子半径的增加,下列递变规律正确的是( )
| A. | 单质的熔沸点逐渐降低 | B. | 卤素离子的还原性逐渐增强 | ||
| C. | 最高正化合价逐渐增大 | D. | 单质的氧化性逐渐增强 |
4.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下面是八种短周期元素的相关信息(已知Be的原子半径为0.089nm)
F原子中无中子,G最高正价为负价绝对值相等,且最外层电子数是次外层的二倍,H元素单质熔色反应呈黄色.
(1)B元素在元素周期表中的位置第三周期ⅢA族.B形成的简单离子的结构示意图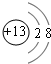 .
.
(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是HClO4(填化学式).
(3)用电子式表示C,H形成化合物的过程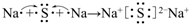 .
.
(4)H,E形成原子个数比为1:1的化合物中所含化学键类型为离子键、共价键.
(5)F与G形成的最简单的化合物的电子式 .
.
(6)E的氢化物比C的氢化物的熔沸点高的原因是水分子之间存在氢键,硫化氢分子之间为范德华力,氢键比范德华力更强.
(7)A,B,C,E所形成的简单离子半径由大到小的顺序为S2->O2->Mg2+>Al3+.
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
(1)B元素在元素周期表中的位置第三周期ⅢA族.B形成的简单离子的结构示意图
 .
.(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是HClO4(填化学式).
(3)用电子式表示C,H形成化合物的过程
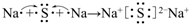 .
.(4)H,E形成原子个数比为1:1的化合物中所含化学键类型为离子键、共价键.
(5)F与G形成的最简单的化合物的电子式
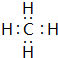 .
.(6)E的氢化物比C的氢化物的熔沸点高的原因是水分子之间存在氢键,硫化氢分子之间为范德华力,氢键比范德华力更强.
(7)A,B,C,E所形成的简单离子半径由大到小的顺序为S2->O2->Mg2+>Al3+.
1.下列叙述能证明某物质是弱电解质的是( )
| A. | 水溶液的导电能力很弱 | |
| B. | 溶液中电离出的离子与未电离的分子共存 | |
| C. | 熔化时不导电 | |
| D. | 不是离子化合物而是共价化合物 |
18.X、Y、Z、M、N代表五种金属,有以下化学反应:
(1)水溶液中X+Y2+═X2++Y;
(2)Z+2H2O(冷水)═Z(OH)2+H2↑;
(3)M、N为电极,与N盐溶液组成原电池,M电极反应为M-2e-═M2+;
(4)Y可以溶于稀硫酸中,M不被稀硫酸氧化.
则这五种金属的活动性由弱到强的顺序是( )
(1)水溶液中X+Y2+═X2++Y;
(2)Z+2H2O(冷水)═Z(OH)2+H2↑;
(3)M、N为电极,与N盐溶液组成原电池,M电极反应为M-2e-═M2+;
(4)Y可以溶于稀硫酸中,M不被稀硫酸氧化.
则这五种金属的活动性由弱到强的顺序是( )
| A. | M<N<Y<X<Z | B. | N<M<X<Y<Z | C. | N<M<Y<X<Z | D. | X<Z<N<M<Y |
 原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.
原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.