题目内容
11.根据下列各题中所给出的数据,可分别求出其“溶质的质量分数”或“溶液的物质的量浓度”,试判断并求解.(1)已知某氢氧化钠溶液V L中含有n个氢氧根离子,可求出此溶液的溶液的物质的量浓度是$\frac{n}{V{N}_{A}}$mol/L;
(2)已知某氢氧化钠溶液中Na+与H2O的个数之比为1:a,则可求出此溶液中溶质的质量分数为$\frac{20}{20+9a}$;
(3)常温下,10.0mL 1.0mol/L的H2SO4(aq),加水稀释到500mL,所得H2SO4(aq)的浓度为0.02mol/L,蒸发浓缩,使溶液的体积为2.40mL,所得H2SO4(aq)的浓度为4.2mol/L.
分析 (1)根据n=$\frac{N}{{N}_{A}}$可计算出氢氧根离子的物质的量,从而得出氢氧化钠的物质的量,再根据c=$\frac{n}{V}$可计算出强氧化钠的物质的量浓度;
(2)根据钠离子和水的个数比可计算出二者物质的量之比,然后根据m=nM得出二者的质量比,从而得出强氧化钠的质量分数;
(3)稀释过程中溶质的物质的量不变,根据n=cV计算出原溶液中硫酸的物质的量,再分别根据c=$\frac{n}{V}$计算出稀释、浓缩后溶液的浓度.
解答 解:(1)n个氢氧根离子的物质的量为:$\frac{n}{{N}_{A}}$mol,强氧化钠为强电解质,则强氧化钠的物质的量为$\frac{n}{{N}_{A}}$mol,
则强氧化钠溶液的物质的量浓度为:$\frac{\frac{n}{{N}_{A}}mol}{VL}$=$\frac{n}{V{N}_{A}}$mol/L,
故答案为:溶液的物质的量浓度;$\frac{n}{V{N}_{A}}$mol/L;
(2)已知某氢氧化钠溶液中Na+与H2O的个数之比为1:a,则强氧化钠与水的物质的量之比为1:a,二者的质量之比为:(40g/mol×1):(18g/mol×a)=20:9a,则该溶液中强氧化钠的质量分数为:$\frac{20}{20+9a}$,
故答案为:溶质的质量分数;$\frac{20}{20+9a}$;
(3)常温下,10.0mL 1.0mol/L的H2SO4(aq)中硫酸的物质的量为:1.0mol/L×0.01L=0.01mol,加水稀释到500mL,稀释过程中溶质的物质的量不变,则所得H2SO4(aq)的浓度为:$\frac{0.01mol}{0.5L}$=0.02mol/L;
蒸发浓缩过程中硫酸的物质的量不变,蒸发浓缩后溶液的体积为2.40mL,则所得H2SO4(aq)的浓度为:$\frac{0.01mol}{0.0024L}$≈4.2mol/L,
故答案为:0.02;4.2.
点评 本题考查了物质的量浓度、溶质质量分数的计算,题目难度中等,明确物质的量浓度、溶质质量分数的概念及表达式为解答关键,试题侧重考查学生的分析、理解能力及化学计算能力.

| A | B | C | D | |
| 碱性 | AOH>BOH | AOH<BOH | AOH>BOH | AOH<BOH |
| 酸性 | HC>HD | HC>HD | HC<HD | HC<HD |
| A. | A | B. | B | C. | C | D. | D |
| A. | 电离能:N>O>F | B. | 物质熔点:H2O>I2>CO2 | ||
| C. | 共价键的极性:C-F>C-O>C-N | D. | 氢化物的稳定性:HBr>HCl>HF |
| A. | CuSO4溶液 | B. | NaOH溶液 | C. | Fe2O3 | D. | 浓硫酸 |
| A. | 向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色 | |
| B. | 向AgCl的饱和溶液中加入KCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl-) | |
| C. | 常温下,AgCl在饱和KCl溶液中的Ksp比在纯水中的Ksp小 | |
| D. | 将0.001 mol•L-1的AgNO3溶液滴入NaCl和NaI的混合溶液中,一定先产生AgI沉淀 |
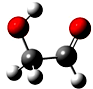 迄今为止科学家在星云中已发现180多种星际分子,寓意着地球上的生命或起源于太空.近年来发现的星际分子乙醇醛球棍模型如图,有关乙醇醛说法错误的是( )
迄今为止科学家在星云中已发现180多种星际分子,寓意着地球上的生命或起源于太空.近年来发现的星际分子乙醇醛球棍模型如图,有关乙醇醛说法错误的是( )| A. | 有2种含氧官能团 | B. | 能发生银镜反应 | ||
| C. | 与葡萄糖互为同系物 | D. | 与乙酸互为同分异构体 |
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ | |
| C. | 反应4 min时,若HCl浓度为0.12 mol•L-1,则H2反应速率为0.03 mol•L-1•min-1 | |
| D. | 当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol•L-1的NaOH溶液恰好反应 |
| A. | 水溶液的导电能力很弱 | |
| B. | 溶液中电离出的离子与未电离的分子共存 | |
| C. | 熔化时不导电 | |
| D. | 不是离子化合物而是共价化合物 |