题目内容
10.设NA为阿伏加德罗常数的数值,下列说法正确的是( )| A. | 标准状况下,11.2 L水中含有分子的数目为0.5NA | |
| B. | 1 mol Cl2与足量的NaOH溶液反应,转移的电子数为1NA | |
| C. | 100 mL 0.2 mol•L-1的FeCl3溶液中,含Fe3+数为0.02NA | |
| D. | 常温常压下,22.4 L的NO2和CO2混合气体含有2NA个O原子 |
分析 A.气体摩尔体积适用对象为气体;
B.根据Cl2与NaOH方程式分析;
C.三价铁离子为弱碱阳离子,水溶液中部分水解;
D.气体摩尔体积适用条件为标况下.
解答 解:A.标况下,水是液态,不能使用气体摩尔体积,故A错误;
B.Cl2与NaOH方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,Cl元素从0价升高到+1价,转移1个电子,所以1mol的Cl2与足量的NaOH溶液反应转移的电子数为NA,故B正确;
C.Fe3+是弱碱阳离子,在溶液中会水解,故溶液中Fe3+的个数小0.02NA个,故C错误;
D.常温常压下,Vm≠22.4L/mol,无法计算,故D错误;
故选:B.
点评 本题考查阿伏加德罗常数的计算及应用,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意气体摩尔体积适用对象,注意三价铁离子的水解,题目难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
20.工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)?Si(s)+4HCl(g);△H=+Q kJ•mol-1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ | |
| C. | 反应4 min时,若HCl浓度为0.12 mol•L-1,则H2反应速率为0.03 mol•L-1•min-1 | |
| D. | 当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol•L-1的NaOH溶液恰好反应 |
1.下列叙述能证明某物质是弱电解质的是( )
| A. | 水溶液的导电能力很弱 | |
| B. | 溶液中电离出的离子与未电离的分子共存 | |
| C. | 熔化时不导电 | |
| D. | 不是离子化合物而是共价化合物 |
18.X、Y、Z、M、N代表五种金属,有以下化学反应:
(1)水溶液中X+Y2+═X2++Y;
(2)Z+2H2O(冷水)═Z(OH)2+H2↑;
(3)M、N为电极,与N盐溶液组成原电池,M电极反应为M-2e-═M2+;
(4)Y可以溶于稀硫酸中,M不被稀硫酸氧化.
则这五种金属的活动性由弱到强的顺序是( )
(1)水溶液中X+Y2+═X2++Y;
(2)Z+2H2O(冷水)═Z(OH)2+H2↑;
(3)M、N为电极,与N盐溶液组成原电池,M电极反应为M-2e-═M2+;
(4)Y可以溶于稀硫酸中,M不被稀硫酸氧化.
则这五种金属的活动性由弱到强的顺序是( )
| A. | M<N<Y<X<Z | B. | N<M<X<Y<Z | C. | N<M<Y<X<Z | D. | X<Z<N<M<Y |
5.某同学为检验某溶液中是否含有常见的四种无机离子,进行了如图所示的实验操作.其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝.由该实验能得到的正确结论是( )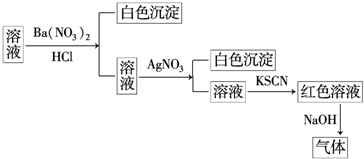

| A. | 原溶液中一定含有SO42- | B. | 原溶液中一定含有NH4+ | ||
| C. | 原溶液中一定含有Cl- | D. | 原溶液中一定含有Fe3+ |
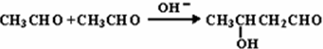
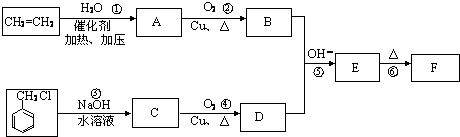
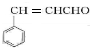 .E中含氧官能团的名称为醛基、羟基.
.E中含氧官能团的名称为醛基、羟基.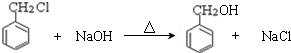
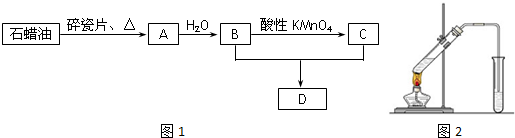
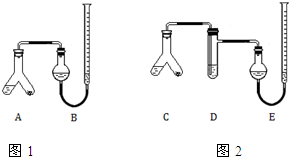 某实验小组分别用图1、2装置测定某种钙片中碳酸钙的含量,夹持装置已略去.
某实验小组分别用图1、2装置测定某种钙片中碳酸钙的含量,夹持装置已略去.