题目内容
10.用NA表示阿伏伽德罗常数的值,下列叙述正确的是(Cu-64 O-32)( )| A. | 1molNa2O${\;}_{{\;}_{2}}$晶体中阴离子的个数为2NA | |
| B. | 标准状况下,2.24L苯所含的分子总数目为0.1NA | |
| C. | 32gO2和32g O3中所含的原子数都是2NA | |
| D. | 6.4g铜与过量的浓硝酸完全反应转移的电子数是0.1NA |
分析 A.过氧化钠中的阴离子为过氧根离子,1mol过氧化钠中含有1mol阴离子;
B.标准状况下,苯的状态不是气体;
C.氧气和臭氧中都只含有氧元素,根据n=$\frac{m}{M}$计算出二者含有的氧原子的物质的量;
D.铜与浓硝酸反应生成铜离子,6.4g铜的物质的量为0.1mol,完全反应转移了0.2mol电子.
解答 解:A.1mol过氧化钠中含有2mol钠离子和1mol过氧根离子,所以含有的阴离子为1mol,阴离子的个数为NA,故A错误;
B.标况下苯不是气体,不能使用标况下的气体摩尔体积计算2.24L苯的物质的量,故B错误;
C.32gO2和32g O3中都含有32g氧原子,含有氧原子的物质的量为:$\frac{32g}{16g/mol}$=2mol,所含的原子数都是2NA,故C正确;
D.6.4g铜的物质的量为:$\frac{6.4g}{64g/mol}$=0.1mol,0.1mol铜与足量浓硝酸反应生成0.1mol铜离子,失去了0.2mol电子,转移的电子数是0.2NA,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的综合应用,题目难度中等,注意掌握标况下气体摩尔体积的使用条件,明确物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的转化关系,B为易错点,注意标况下苯不是气体.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
19.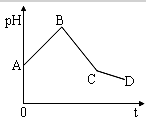 将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是( )
将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是( )
 将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是( )
将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是( )| A. | 阳极产物一定是Cl2,阴极产物一定是Cu | |
| B. | BC段表示在阴极上是H+放电产生了H2 | |
| C. | 整个过程中阳极先产生Cl2,后产生O2 | |
| D. | CD段表示的电解过程中水的电离被促进 |
1.已知A、B、C、D为短周期元素,请根据下表信息回答问题.
(1)A有8、9、10个中子的三种核素,它们之间称同位素,B在元素周期表的位置:第二周期VA族,B的氢化物水溶液显碱性的原因NH3+H2O=NH3•H2O=NH4++OH-.
(2)C的原子结构示意图为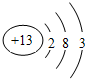 ,C单质与NaOH溶液反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑.
,C单质与NaOH溶液反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑.
(3)D的单质与A的一种氢化物反应生成具有漂白性的物质,反应的化学方程式为:Cl2+H2O=HCl+HClO.
(4)D的最高价氧化物对应的水化物的分子式为HClO4,其酸性比H2SO4强(填“强”或“弱”).
| 元素 | A | B | C | D |
| 性质或结构信息 | 工业上通过分离液态空气获得其单质,单质能助燃 | 气态氢化物显碱性 | +3价阳离子的核外电子排布与氖原子相同 | 第三周期原子半径最小 |
(2)C的原子结构示意图为
 ,C单质与NaOH溶液反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑.
,C单质与NaOH溶液反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑.(3)D的单质与A的一种氢化物反应生成具有漂白性的物质,反应的化学方程式为:Cl2+H2O=HCl+HClO.
(4)D的最高价氧化物对应的水化物的分子式为HClO4,其酸性比H2SO4强(填“强”或“弱”).
18.下列化学现象的描述正确、解释合理的是( )
| 选项 | 实验 | 现象 | 结论或解释 |
| A | 向溶液中滴加少量氯水,再滴加KSCN溶液 | 溶液变红 | 证明溶液中含有Fe2+ |
| B | 用铜与稀硫酸检验溶液中的 NO3- | 加热后,试管口有红棕色气体产生 | 硝酸根离子在酸性条件下与铜反应生成NO2 |
| C | 将铝箔放在火焰上灼烧 | 熔化物悬挂不下落 | 铝表面生成高熔点氧化铝未熔化 |
| D | 用盐酸标准液滴定未知浓度的Na2CO3溶液 | 分别用甲基橙和酚酞做指示剂时消耗盐酸的体积相等 | 标准液的用量只与待测液的物质的量有关,与指示剂无关 |
| A. | A | B. | B | C. | C | D. | D |
5.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 78g苯含有C=C键的数目为3NA | |
| B. | 室温时,8g SO3分子中氧原子的数目为0.3NA | |
| C. | 在反应中KClO4+8HCl=KCl+4Cl2↑+4H2O,每生成4molCl2转移的电子数目为8NA | |
| D. | 1molFeCl2与足量氯气反应时转移的电子数为2NA |
15.设NA为伏加的罗常数的值.下列说法正确的是( )
| A. | 常温下,0.05mol•L1Fe2(SO4)3溶液中含Fe3+数目小于0.1NA | |
| B. | 30g甲醛中含4NA对电子 | |
| C. | 7.8g过氧化钠中含有0.1NA个阴离子 | |
| D. | 标准状况下,22.4L乙烷含有的分子数为NA |
2.新型材料B4C可用于制作切削工具和高温热交换器.关于B4C的推断正确的是( )
| A. | B4C是一种分子晶体 | B. | B4C是该物质的分子式 | ||
| C. | B4C是一种原子晶体 | D. | 电子式为: |
19.第三周期元素的原子中,未成对电子不可能有( )
| A. | 4个 | B. | 3个 | C. | 2个 | D. | 1个 |