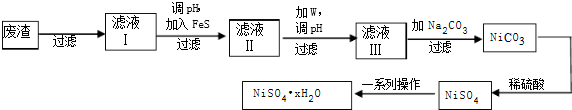
题目内容
18.下列化学现象的描述正确、解释合理的是( )| 选项 | 实验 | 现象 | 结论或解释 |
| A | 向溶液中滴加少量氯水,再滴加KSCN溶液 | 溶液变红 | 证明溶液中含有Fe2+ |
| B | 用铜与稀硫酸检验溶液中的 NO3- | 加热后,试管口有红棕色气体产生 | 硝酸根离子在酸性条件下与铜反应生成NO2 |
| C | 将铝箔放在火焰上灼烧 | 熔化物悬挂不下落 | 铝表面生成高熔点氧化铝未熔化 |
| D | 用盐酸标准液滴定未知浓度的Na2CO3溶液 | 分别用甲基橙和酚酞做指示剂时消耗盐酸的体积相等 | 标准液的用量只与待测液的物质的量有关,与指示剂无关 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.先加入氯水,不能排出Fe3+的影响;
B.铜与稀硫酸反应生成NO;
C.将铝箔放在火焰上灼烧生成氧化铝,熔化物悬挂不下落,说明氧化铝熔点高与铝;
D.分别用甲基橙和酚酞做指示剂时消耗盐酸的体积不可能相等.
解答 解:A.用KSCN鉴别Fe2+时,先加上KSN,不变色,再滴加氯水,溶液变红,故A错误;
B.铜与稀硝酸反应生成NO,在试管口转化为NO2,故B错误;
C.铝熔点低,但氧化生成的氧化铝熔点高,包裹在熔化的铝外面,所以铝熔而不落,故C正确;
D.当用甲基橙时,滴定终点呈酸性,生成二氧化碳和氯化钠,当用酚酞时,滴定终点呈碱性,生成碳酸氢钠,用甲基橙和酚酞做指示剂时消耗盐酸的体积为2:1,故D错误.
故选C.
点评 本题考查化学实验方案的评价,涉及气体的制备、物质的检验、滴定等,注意化学实验操作的考查,熟悉高考中对化学实验注意事项及操作要点的考查,题目难度中等.

练习册系列答案
相关题目
7.能与KOH的醇溶液发生消去反应的是( )
| A. | (CH3CH2)3CCH2Cl | B. | CH3Cl | C. | 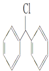 | D. | 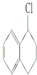 |
9.下列说法正确的是( )
| A. | 漂白液中添加醋酸可提高漂白速率 | |
| B. | 石油裂化是为了除去石油中的杂质 | |
| C. | 淀粉溶液可鉴别加碘盐的真伪 | |
| D. | 蛋白质、淀粉、纤维素都能在人体内水解并提供能量 |
6.已知:99℃时,Kw=1.0×10-12.在该温度下,测得0.1mol.L-1 Na2A溶液pH=6.则下列说法正确的是( )
| A. | H2A在水溶液中的电离方程式为:H2A?2H++A2- | |
| B. | 0.1mol.L-1的H2A溶液pH<2 | |
| C. | 体积相等pH=1的盐酸与H2A溶液分别与足量的Zn反应,H2A溶液产生的H2多 | |
| D. | (NH4)2 A溶液中存在离子浓度关系:c(A2- )>C(NH4+ )>C(H+ )>C(OH- ) |
13.某pH=1的X溶液中可能含有Fe2+、Al3+,NH4+、CO32-、SO42-、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如下:下列说法正确的是( )
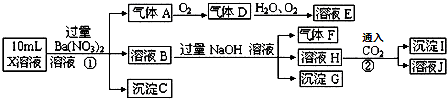

| A. | 气体A是NO2 | |
| B. | X中肯定存在Fe2+、A13+、NH4+、SO42- | |
| C. | 溶液E和气体F不能发生化学反应 | |
| D. | X中不能确定的离子是 A13+和C1- |
10.用NA表示阿伏伽德罗常数的值,下列叙述正确的是(Cu-64 O-32)( )
| A. | 1molNa2O${\;}_{{\;}_{2}}$晶体中阴离子的个数为2NA | |
| B. | 标准状况下,2.24L苯所含的分子总数目为0.1NA | |
| C. | 32gO2和32g O3中所含的原子数都是2NA | |
| D. | 6.4g铜与过量的浓硝酸完全反应转移的电子数是0.1NA |
7.将下列物质分别加入溴水中,不能使溴水褪色的是( )
| A. | Na2SO3晶体 | B. | 乙醇 | C. | C6H6 | D. | Fe |
 磷单质及其化合物有广泛应用.
磷单质及其化合物有广泛应用. )之间脱去两个水分子的产物,其结构简式为
)之间脱去两个水分子的产物,其结构简式为 .三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.
.三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.