题目内容
15.设NA为伏加的罗常数的值.下列说法正确的是( )| A. | 常温下,0.05mol•L1Fe2(SO4)3溶液中含Fe3+数目小于0.1NA | |
| B. | 30g甲醛中含4NA对电子 | |
| C. | 7.8g过氧化钠中含有0.1NA个阴离子 | |
| D. | 标准状况下,22.4L乙烷含有的分子数为NA |
分析 A.没有告诉硫酸铁溶液的体积,且铁离子部分水解,导致铁离子数目减少,无法计算溶液中铁离子数目;
B.甲醛的电子式为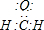 ,分子中含有4对共用电子对和2对孤对电子,总共含有6对电子对;
,分子中含有4对共用电子对和2对孤对电子,总共含有6对电子对;
C.过氧化钠中含有的阴离子为过氧根离子,7.8g过氧化钠的物质的量为0.1mol,含有0.1mol阴离子;
D.标况下22.4L乙烷的物质的量为1mol.
解答 解:A.没有告诉硫酸铁溶液的体积,无法计算溶液中铁离子的数目,故A错误;
B.30g甲醛的物质的量为1mol,1mol甲醛中含有6mol电子对,含有电子对数为6NA,故B错误;
C.7.8g过氧化钠的物质的量为:$\frac{7.8g}{78g/mol}$=0.1mol,0.1mol过氧化钠中含有0.1mol过氧根离子,含有0.1NA个阴离子,故C正确;
D.标准状况下,22.4L乙烷的物质的量为:$\frac{22.4L}{22.4L/mol}$=1mol,乙烷含有的分子数为NA,故D正确;
故选CD.
点评 本题考查了阿伏伽德罗常数的应用,题目难度中等,注意掌握阿伏伽德罗常数与物质的量、摩尔质量等物理量之间的转化关系,B为易错点,注意共用电子对与电子对的区别,试题培养了学生的分析能力及计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.实验中对某苯的同系物经元素分析测得其分子式为C10H14,经鉴定结构可知分子式中除含苯环外,还含有两个“-CH3”,一个“-CH2-”,一个“CH”,它的可能结构有( )
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 2种 |
6.已知:99℃时,Kw=1.0×10-12.在该温度下,测得0.1mol.L-1 Na2A溶液pH=6.则下列说法正确的是( )
| A. | H2A在水溶液中的电离方程式为:H2A?2H++A2- | |
| B. | 0.1mol.L-1的H2A溶液pH<2 | |
| C. | 体积相等pH=1的盐酸与H2A溶液分别与足量的Zn反应,H2A溶液产生的H2多 | |
| D. | (NH4)2 A溶液中存在离子浓度关系:c(A2- )>C(NH4+ )>C(H+ )>C(OH- ) |
10.用NA表示阿伏伽德罗常数的值,下列叙述正确的是(Cu-64 O-32)( )
| A. | 1molNa2O${\;}_{{\;}_{2}}$晶体中阴离子的个数为2NA | |
| B. | 标准状况下,2.24L苯所含的分子总数目为0.1NA | |
| C. | 32gO2和32g O3中所含的原子数都是2NA | |
| D. | 6.4g铜与过量的浓硝酸完全反应转移的电子数是0.1NA |
20.短周期元素X、Y、Z在元素周期表中的位置如图,已知X与Y的原子序数之和等于Z的原子序数.下列说法错误的是( )
| X | Y | |
| Z |
| A. | Y的气态氢化物比X的最简单气态氢化物的稳定性高 | |
| B. | 在X、Y、Z三种元素中,只有X的最高价氧化物对应的水化物与它的气态氢化物可以反应生成盐 | |
| C. | 由X、Y、Z分别形成的单质,常温下Z单质的沸点最高 | |
| D. | 在标准状况下,1molY 的氢化物的体积约为22.4L |
7.将下列物质分别加入溴水中,不能使溴水褪色的是( )
| A. | Na2SO3晶体 | B. | 乙醇 | C. | C6H6 | D. | Fe |
4.等温等压下,有质子数相等的CO、N2、C2H2三种气体,下列叙述中正确的是( )
| A. | 体积之比13:13:14 | B. | 密度之比14:14:13 | ||
| C. | 质量之比1:1:1 | D. | 原子数之比1:1:1 |
 磷单质及其化合物有广泛应用.
磷单质及其化合物有广泛应用. )之间脱去两个水分子的产物,其结构简式为
)之间脱去两个水分子的产物,其结构简式为 .三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.
.三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.