题目内容
5.设NA为阿伏加德罗常数,下列说法正确的是( )| A. | 78g苯含有C=C键的数目为3NA | |
| B. | 室温时,8g SO3分子中氧原子的数目为0.3NA | |
| C. | 在反应中KClO4+8HCl=KCl+4Cl2↑+4H2O,每生成4molCl2转移的电子数目为8NA | |
| D. | 1molFeCl2与足量氯气反应时转移的电子数为2NA |
分析 A、苯不是单双键交替的结构;
B、求出三氧化硫的物质的量,然后根据1mol三氧化硫中含3mol氧原子来分析;
C、此反应转移7mol电子;
D、FeCl2中Fe2+被氧化为Fe3+.
解答 解:A、苯不是单双键交替的结构,不含碳碳双键,故A错误;
B、8g三氧化硫的物质的量为0.1mol,而1mol三氧化硫中含3mol氧原子,故0.1mol三氧化硫中含0.3mol氧原子,故B正确;
C、此反应是归中反应,转移7mol电子时生成4mol氯气,故每生成4molCl2转移的电子数目为7NA,故C错误;
D、FeCl2中Fe2+被氧化为Fe3+,故1molFeCl2与氯气反应时转移1mol电子,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
14.下列变化过程中,一定发生了化学变化的是( )
| A. | 蒸馏 | B. | 升华 | C. | 爆炸 | D. | 燃烧 |
16.X、Y、Z、W、R属于短周期元素.已知它们都不是稀有气体元素,X的原子半径最大,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1. 下列叙述错误的是( )
| A. | X与Y形成的两种化合物中阴、阳离子的个数比均为1:2 | |
| B. | Y分别与Z、W、R以两种元素组成的常见化合物有5种 | |
| C. | Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z | |
| D. | Y的氢化物比R的氢化物稳定,Y的氢化物熔沸点比R的氢化物低 |
13.某pH=1的X溶液中可能含有Fe2+、Al3+,NH4+、CO32-、SO42-、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如下:下列说法正确的是( )
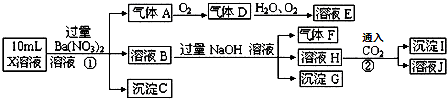

| A. | 气体A是NO2 | |
| B. | X中肯定存在Fe2+、A13+、NH4+、SO42- | |
| C. | 溶液E和气体F不能发生化学反应 | |
| D. | X中不能确定的离子是 A13+和C1- |
10.用NA表示阿伏伽德罗常数的值,下列叙述正确的是(Cu-64 O-32)( )
| A. | 1molNa2O${\;}_{{\;}_{2}}$晶体中阴离子的个数为2NA | |
| B. | 标准状况下,2.24L苯所含的分子总数目为0.1NA | |
| C. | 32gO2和32g O3中所含的原子数都是2NA | |
| D. | 6.4g铜与过量的浓硝酸完全反应转移的电子数是0.1NA |
17.化学与社会、生产、生活紧密相关,下列说法正确的是( )
| A. | 绿色化学的核心是利用化学原理对环境污染进行治理 | |
| B. | 自来水可用氯气来杀菌消毒.说明氯气无毒 | |
| C. | 纯碱可用于生产普通玻璃,日常生活中也可用纯碱溶液来除去物品表面的油污 | |
| D. | 从海水中提取物质都必须通过化学反应才能实现 |
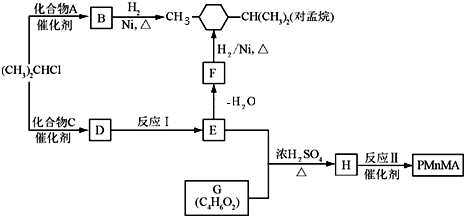

 .
.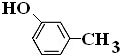 .
. .
.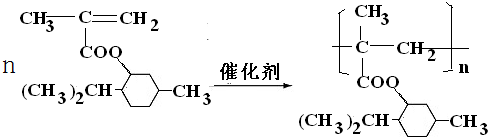 .
.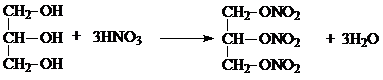 .
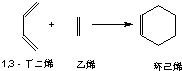
.
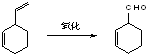
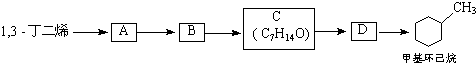
 ;B
;B