题目内容
19.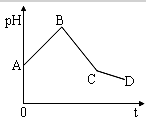 将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是( )
将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是( )| A. | 阳极产物一定是Cl2,阴极产物一定是Cu | |
| B. | BC段表示在阴极上是H+放电产生了H2 | |
| C. | 整个过程中阳极先产生Cl2,后产生O2 | |
| D. | CD段表示的电解过程中水的电离被促进 |
分析 设CuSO4的和NaCl各nmol,电解分3个阶段:
AB段:阳极:nmol氯离子失nmol电子,阴极:$\frac{1}{2}$nmol铜离子得nmol电子,由于铜离子水解使溶液酸性减弱,铜离子浓度逐渐减小,溶液pH值逐渐增大;
BC段:阳极:nmol氢氧根离子失nmol电子(来源于水的电离),阴极:$\frac{1}{2}$n mol铜离子再得nmol电子,由于氢氧根离子消耗,溶液中氢离子浓度增大,溶液的pH值迅速减小;
CD段:阳极:氢氧根离子失去电子,阴极:氢离子得到电子,开始电解水,溶液中氢离子浓度逐渐增大,pH值减小,根据以上分析进行判断.
解答 解:设CuSO4的和NaCl各nmol,电解分3个阶段:
AB段:阳极:nmol氯离子失nmol电子,阴极:$\frac{1}{2}$nmol铜离子得nmol电子,由于铜离子水解使溶液酸性减弱,铜离子浓度逐渐减小,溶液pH值逐渐增大;
BC段:阳极:nmol氢氧根离子失nmol电子(来源于水的电离),阴极:$\frac{1}{2}$n mol铜离子再得nmol电子,由于氢氧根离子消耗,溶液中氢离子浓度增大,溶液的pH值迅速减小;
CD段:阳极:氢氧根离子失去电子,阴极:氢离子得到电子,开始电解水,溶液中氢离子浓度逐渐增大,pH值减小,
A、电解开始时,阳极先发生2Cl--2e-═Cl2↑,后发生4OH--4e-═2H2O+O2↑,阴极反应先发生Cu2++2e-═Cu,后发生2H++2e-═H2↑,故A错误;
B、BC段阳极发生的电极反应是:4OH--4e-═2H2O+O2↑,阴极铜离子得到电子,生成铜单质,故B错误;
C、阳极先发生2Cl--2e-═Cl2↑,后发生4OH--4e-═2H2O+O2↑,故C正确;
D、CD段发生2H++2e-═H2↑、4OH--4e-═2H2O+O2↑,即CD段电解的物质是水,故D错误;
故选:C.
点评 本题考查电解原理,明确电解过程中离子的移动及离子的放电顺序、发生的电极反应是解答本题的关键,并注意结合图象来分析解答,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 硫酸钾溶液 | B. | 醋酸 | C. | 氯化钠(固体) | D. | 盐酸 |
| A. | Mg、Al、B | B. | N、O、S | C. | Li、Be、Mg | D. | B、F、Cl |
| A. | (CH3CH2)3CCH2Cl | B. | CH3Cl | C. | 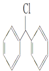 | D. | 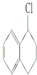 |
| A. | 蒸馏 | B. | 升华 | C. | 爆炸 | D. | 燃烧 |
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 2种 |
| A. | 用NaOH溶液滴定醋酸时,可用酚酞试液作指示剂 | |
| B. | 花生油、菜子油漕油等水解时可得到一种共同的产物 | |
| C. | NH3+HCl=NH4Cl能自发进行,其△H一定小于零 | |
| D. | 甲烷和氯气反应与苯和硝酸反应的反应类型不同 |
| A. | 漂白液中添加醋酸可提高漂白速率 | |
| B. | 石油裂化是为了除去石油中的杂质 | |
| C. | 淀粉溶液可鉴别加碘盐的真伪 | |
| D. | 蛋白质、淀粉、纤维素都能在人体内水解并提供能量 |
| A. | 1molNa2O${\;}_{{\;}_{2}}$晶体中阴离子的个数为2NA | |
| B. | 标准状况下,2.24L苯所含的分子总数目为0.1NA | |
| C. | 32gO2和32g O3中所含的原子数都是2NA | |
| D. | 6.4g铜与过量的浓硝酸完全反应转移的电子数是0.1NA |