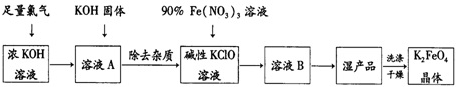
题目内容
19.在某无色透明的碱性溶液中,能共存的离子组是( )| A. | Na+、K+、SO42-、HCO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Fe3+、K+、SO42-、Cl- | D. | Na+、K+、Cl-、NO3- |
分析 无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,强碱性溶液中存在大量氢氧根离子,
A.碳酸氢根离子与强碱性溶液中的氢氧根离子反应;
B.铜离子为有色离子,不满足溶液无色的条件;
C.Fe3+为有色离子,不满足溶液无色的要求;
D.四种离子之间不反应,都不与氢氧根离子反应,且为无色溶液.
解答 解:溶液无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,强碱性溶液中存在大量氢氧根离子,
A.HCO3-与氢氧根离子反应,在溶液中不能大量共存,故A错误;
B.Cu2+为有色离子,不满足溶液无色的要求,故B错误;
C.Fe3+为有色离子,在溶液中不能大量存在,故C错误;
D.Na+、K+、Cl-、NO3-之间不发生反应,都为无色离子,且都不与氢氧根离子反应,在溶液中能大量共存,故D正确;
故选D.
点评 本题考查离子共存,为高考的高频题,属于中等难度的试题,明确离子反应发生条件为解答关键,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识的能力.

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
10.下列有关实验操作或判断不正确的是( )
| A. | 用10mL量筒量取稀硫酸溶液 8.0mL | |
| B. | 用干燥的pH试纸测定氯水的pH | |
| C. | 用碱式滴定管量取KMnO4溶液 19.60mL | |
| D. | 使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度偏大 | |
| E. | 圆底烧瓶、锥形瓶、蒸发皿加热时都应垫在石棉网上 |
14.根据下列实验内容得出的结论正确的是( )
| 选项 | 实验内容 | 结论 |
| A | 一红棕色气体能使湿润的KI-淀粉试纸变蓝 | 证明该红棕色气体一定为溴蒸气 |
| B | 向某溶液中加入氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| C | 铝箔在酒精灯火焰上加热熔化但不滴落 | 说明铝箔表面氧化铝膜熔点高于铝 |
| D | 取少量待测晶体于试管中,加浓的NaOH溶液并加热,试管口湿润的红色石蕊试纸变蓝 | 证明晶体成分中含有NH4+ |
| A. | A | B. | B | C. | C | D. | D |
4.将3.2g Cu与足量的浓硫酸在加热条件下充分反应.
(1)被还原的硫酸的物质的量为0.05mol.
(2)把反应后的溶液稀释至500ml,取出50ml,向其中加入足量的BaCl2溶液,得到沉淀20.27g,则稀释后所得溶液中SO42-的物质的量浓度为1.74mol/L(保留两位小数).
(3)若浓硫酸中含溶质为a mol,投入足量的铜片并加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)<0.5amol.
(4)将产生的气体缓慢通入100ml b mol/L的氢氧化钠溶液中,若反应物均无剩余,则b的取值范围为0.5≤b≤1.
(5)讨论b的取值范围及与之对应的溶液的溶质及其物质的量,将结果填于下表中
(1)被还原的硫酸的物质的量为0.05mol.
(2)把反应后的溶液稀释至500ml,取出50ml,向其中加入足量的BaCl2溶液,得到沉淀20.27g,则稀释后所得溶液中SO42-的物质的量浓度为1.74mol/L(保留两位小数).
(3)若浓硫酸中含溶质为a mol,投入足量的铜片并加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)<0.5amol.
(4)将产生的气体缓慢通入100ml b mol/L的氢氧化钠溶液中,若反应物均无剩余,则b的取值范围为0.5≤b≤1.
(5)讨论b的取值范围及与之对应的溶液的溶质及其物质的量,将结果填于下表中
| b的范围 | 溶质的种类 | 溶质的物质的量(mol) |
| 0.5 | NaHSO3 | 0.05 |
11.下列过程或现象与盐类水解无关的是( )
| A. | 加热蒸干并灼烧FeCl3溶液,得到Fe2O3固体 | |
| B. | 铁在潮湿的环境下生锈 | |
| C. | 明矾净水 | |
| D. | 浓硫化钠溶液有臭味 |
8.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上常采用下列反应合成甲醇:CO(g)+2H2(g)═CH3OH(g)△H1
①下表所列数据是上述反应在不同温度下的化学平衡常数(K).
由表中数据判断△H1<0 (填“>”、“=”或“<”).
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为80%.
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g);△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g);△H=-566.0kJ/mol
③H2O(g)=H2O(l);△H=-44.0kJ/mol
请计算1mol甲醇不完全燃烧生成1mol一氧化碳和液态水放出的热量为266.8kJ.
(1)工业上常采用下列反应合成甲醇:CO(g)+2H2(g)═CH3OH(g)△H1
①下表所列数据是上述反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为80%.
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g);△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g);△H=-566.0kJ/mol
③H2O(g)=H2O(l);△H=-44.0kJ/mol
请计算1mol甲醇不完全燃烧生成1mol一氧化碳和液态水放出的热量为266.8kJ.
9.有体积相同、pH相等的烧碱溶液和氨水,下列叙述中正确的是( )
| A. | 两溶液中OH-离子浓度相同 | |
| B. | 用同浓度的盐酸中和时,消耗盐酸的体积相同 | |
| C. | 两溶液溶质物质的量浓度相同 | |
| D. | 加入等体积的水稀释后,它们的pH仍相等 |