题目内容
11.下列过程或现象与盐类水解无关的是( )| A. | 加热蒸干并灼烧FeCl3溶液,得到Fe2O3固体 | |
| B. | 铁在潮湿的环境下生锈 | |
| C. | 明矾净水 | |
| D. | 浓硫化钠溶液有臭味 |
分析 A、FeCl3水解生成氢氧化铁,加热促进水解;
B、根据铁生锈的条件来回答;
C、明矾溶于水后,电离出的Al3+水解出Al(OH)3能吸附杂质;
D、Na2S是强碱弱酸盐,在溶液中会水解.
解答 解:A、FeCl3水解生成氢氧化铁,加热促进水解,水解生成的氢氧化铁加热分解生成Fe2O3,故A错误;
B、铁生锈的条件:和氧气、水接触,与盐类水解无关,故B正确;
C、明矾溶于水后,电离出的Al3+水解出Al(OH)3能吸附杂质,能起到净水的作用,故明矾净水与盐类的水解有关,故C错误;
D、Na2S是强碱弱酸盐,在溶液中会水解:S2-+H2O?HS-+OH-,HS-+H2O?H2S+OH-,水解生成的H2S有臭鸡蛋气味,与盐类的水解有关,故D错误.
故选B.
点评 本题主要考查了盐类水解知识,同时还涉及酯的水解、钢铁的电化学腐蚀等知识,侧重于基础知识的考查,题目难度不大.

练习册系列答案
相关题目
2.用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶液于一洁净的锥形瓶中,然后用0.2000mol•L-1的氢氧化钠溶液(指示剂为酚酞)滴定得结果如下:
(1)达到滴定终点的时溶液颜色的变化为无色到浅红色;
(2)根据以上数据可以计算出盐酸的物质的量浓度为0.1448mol/L;
(3)以下操作造成测定结果偏高的原因可能是CD.
A、滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B、盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C、滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D、未用标准液润洗碱式滴定管.
| NaOH起始读数 | NaOH终点读数 | |
| 第一次 | 0.40mL | 18.50mL |
| 第二次 | 1.30mL | 18.05mL |
| 第三次 | 3.10mL | 21.20mL |
(2)根据以上数据可以计算出盐酸的物质的量浓度为0.1448mol/L;
(3)以下操作造成测定结果偏高的原因可能是CD.
A、滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B、盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C、滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D、未用标准液润洗碱式滴定管.
19.在某无色透明的碱性溶液中,能共存的离子组是( )
| A. | Na+、K+、SO42-、HCO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Fe3+、K+、SO42-、Cl- | D. | Na+、K+、Cl-、NO3- |
6.下列有机物的命名正确的是( )
| A. | 1-甲基戊烷 | B. | 2,3-二甲基戊烷 | C. | 3-戊烯 | D. | 3,4-二甲基戊烷 |
16.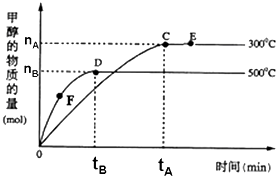 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g)?CH3OH(g),根据题意,以下说法正确的是( )
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g)?CH3OH(g),根据题意,以下说法正确的是( )
 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g)?CH3OH(g),根据题意,以下说法正确的是( )
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g)?CH3OH(g),根据题意,以下说法正确的是( )| A. | 正反应的△H<0 | |
| B. | 容器中气体的总物质的量E点大于D点 | |
| C. | F点的正反应速率大于逆反应速率 | |
| D. | v(甲醇)=$\frac{{n}_{B}}{3{t}_{B}}$mol/(L•min)表示500℃时反应在D点的速率 |
3.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 25℃时,0.1mol/L的 pH=4.5的NaHC2O4溶液:c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| B. | 25℃时,pH=9、浓度均为0.1 mol/L的NH3•H2O和NH4Cl混合溶液:c(NH4+)+c(H+)>c(NH3•H2O)+c(OH-) | |
| C. | NaHCO3溶液:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) | |
| D. | 0.1mol/L(NH4)2Fe(SO4)2溶液中:c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-) |
20.在下列各组溶液中,离子一定能大量共存的是( )
| A. | 强碱性溶液中:Na+、K+、SO42-、AlO2- | |
| B. | 含有0.1 mol•L-1Fe3+的溶液中:K+、Mg2+、Cl-、SCN- | |
| C. | 某无色溶液中:NH4+、Fe2+、MnO4-、NO3- | |
| D. | 与铝反应生成H2的溶液中:Na+、K+、Cl-、SO42- |
1.相同物质的量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是( )
| A. | Al | B. | Al(OH)3 | C. | AlCl3 | D. | Al2O3 |
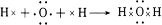 .
. ,属于离子化合物(填“离子化合物”,“共价化合物”)
,属于离子化合物(填“离子化合物”,“共价化合物”)