题目内容
10.下列有关实验操作或判断不正确的是( )| A. | 用10mL量筒量取稀硫酸溶液 8.0mL | |
| B. | 用干燥的pH试纸测定氯水的pH | |
| C. | 用碱式滴定管量取KMnO4溶液 19.60mL | |
| D. | 使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度偏大 | |
| E. | 圆底烧瓶、锥形瓶、蒸发皿加热时都应垫在石棉网上 |
分析 A.量筒的感量是0.1mL;
B.次氯酸具有漂白性;
C.碱式滴定管只能盛放碱性溶液,酸式滴定管只能盛放酸性溶液;
D.俯视液面定容时导致溶液体积偏小;
E.蒸发皿不需要垫石棉网.
解答 解:A.量筒的感量是0.1mL,所以用10mL量筒量取稀硫酸溶液 8.0mL正确,故A正确;
B.氯气和水反应生成的次氯酸具有漂白性,会导致测定的pH不准确,故B错误;
C.碱式滴定管只能盛放碱性溶液,酸式滴定管只能盛放酸性溶液,高锰酸钾溶液呈酸性,所以只能用酸式滴定管盛放酸性高锰酸钾溶液,故C错误;
D.俯视液面定容时导致溶液体积偏小,溶质物质的量不变,所以配制溶液浓度偏高,故D正确;
E.蒸发皿不需要垫石棉网,圆底烧瓶和锥形瓶需要垫石棉网,故E错误;
故选BCE.
点评 本题考查实验方案评价,为高频考查,侧重考查实验操作、实验仪器的选取及使用等知识点,明确仪器的用途、物质的性质及操作规范性是解本题关键,易错选项是B.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
11.钡和钠相似,也能形成O22-离子的过氧化物,则下列叙述错误的是( )
| A. | 1mol过氧化钠或过氧化钡跟足量水反应都生成0.5mol氧气 | |
| B. | 过氧化钡的化学式是Ba2O2 | |
| C. | 过氧化钡是离子化合物 | |
| D. | 过氧化钠和过氧化钡都是强氧化剂 |
5.下列反应的离子方程式正确且表示复分解反应的是( )
| A. | 钠跟水的反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| C. | 碳酸氢钙溶液加入过量的氢氧化钠溶液:HCO3-+OH-═CO32-+H2O | |
| D. | 碳酸氢钠溶液中加入盐酸:HCO3-+H+═CO2↑+H2O |
15.化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | MgO的熔点很高,可用于制作耐高温材料 | |
| D. | 电解AlCl3饱和溶液,可制得金属铝 |
2.用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶液于一洁净的锥形瓶中,然后用0.2000mol•L-1的氢氧化钠溶液(指示剂为酚酞)滴定得结果如下:
(1)达到滴定终点的时溶液颜色的变化为无色到浅红色;
(2)根据以上数据可以计算出盐酸的物质的量浓度为0.1448mol/L;
(3)以下操作造成测定结果偏高的原因可能是CD.
A、滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B、盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C、滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D、未用标准液润洗碱式滴定管.
| NaOH起始读数 | NaOH终点读数 | |
| 第一次 | 0.40mL | 18.50mL |
| 第二次 | 1.30mL | 18.05mL |
| 第三次 | 3.10mL | 21.20mL |
(2)根据以上数据可以计算出盐酸的物质的量浓度为0.1448mol/L;
(3)以下操作造成测定结果偏高的原因可能是CD.
A、滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B、盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C、滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D、未用标准液润洗碱式滴定管.
19.在某无色透明的碱性溶液中,能共存的离子组是( )
| A. | Na+、K+、SO42-、HCO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Fe3+、K+、SO42-、Cl- | D. | Na+、K+、Cl-、NO3- |
20.在下列各组溶液中,离子一定能大量共存的是( )
| A. | 强碱性溶液中:Na+、K+、SO42-、AlO2- | |
| B. | 含有0.1 mol•L-1Fe3+的溶液中:K+、Mg2+、Cl-、SCN- | |
| C. | 某无色溶液中:NH4+、Fe2+、MnO4-、NO3- | |
| D. | 与铝反应生成H2的溶液中:Na+、K+、Cl-、SO42- |
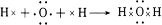 .
. ,属于离子化合物(填“离子化合物”,“共价化合物”)
,属于离子化合物(填“离子化合物”,“共价化合物”)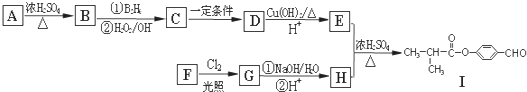
 .
. .E与H反应生成I的方程式为
.E与H反应生成I的方程式为 .
.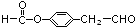 .
.