题目内容
8.甲醇是一种可再生能源,具有广泛的开发和应用前景.(1)工业上常采用下列反应合成甲醇:CO(g)+2H2(g)═CH3OH(g)△H1
①下表所列数据是上述反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为80%.
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g);△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g);△H=-566.0kJ/mol
③H2O(g)=H2O(l);△H=-44.0kJ/mol
请计算1mol甲醇不完全燃烧生成1mol一氧化碳和液态水放出的热量为266.8kJ.
分析 (1)①根据表格温度越高,平衡常数越小,说明升温平衡向逆反应方向移动,据此分析;
②根据一氧化碳的平衡浓度计算平衡时一氧化碳的物质的量,再根据转化率公式计算其转化率;
(2)根据盖斯定律,将已知反应(①-②-③×4)÷2计算得到;
解答 解:(1)①根据表格温度越高,平衡常数越小,说明升温平衡向逆反应方向移动,所以该反应是放热反应,则△H1<0,故答案为:<;
②平衡时剩余一氧化碳的物质的量=0.2mol/L×2L=0.4mol,一氧化碳的转化率=$\frac{(2-0.4)mol}{2mol}$×100%=80%,
故答案为:80%;
(2)根据盖斯定律,将已知反应(①-②+③×4)÷2得到CH3OH(l)+O2(g)=CO(g)+2H2O(l),所以该反应的△H=$\frac{1}{2}$[(-1275.6kJ/mol)-(-566.0kJ/mol)-(-44.0kJ/mol)×4]=-266.8kJ•mol-1,故答案为:266.8;
点评 本题考查化学平衡常数、化学平衡计算、盖斯定律的应用等,熟练掌握基础是关键,难度中等.

练习册系列答案
相关题目
19.在某无色透明的碱性溶液中,能共存的离子组是( )
| A. | Na+、K+、SO42-、HCO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Fe3+、K+、SO42-、Cl- | D. | Na+、K+、Cl-、NO3- |
16.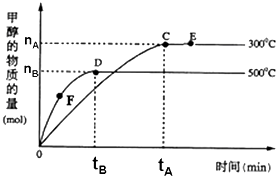 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g)?CH3OH(g),根据题意,以下说法正确的是( )
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g)?CH3OH(g),根据题意,以下说法正确的是( )
 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g)?CH3OH(g),根据题意,以下说法正确的是( )
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g)?CH3OH(g),根据题意,以下说法正确的是( )| A. | 正反应的△H<0 | |
| B. | 容器中气体的总物质的量E点大于D点 | |
| C. | F点的正反应速率大于逆反应速率 | |
| D. | v(甲醇)=$\frac{{n}_{B}}{3{t}_{B}}$mol/(L•min)表示500℃时反应在D点的速率 |
3.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 25℃时,0.1mol/L的 pH=4.5的NaHC2O4溶液:c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| B. | 25℃时,pH=9、浓度均为0.1 mol/L的NH3•H2O和NH4Cl混合溶液:c(NH4+)+c(H+)>c(NH3•H2O)+c(OH-) | |
| C. | NaHCO3溶液:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) | |
| D. | 0.1mol/L(NH4)2Fe(SO4)2溶液中:c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-) |
13.对于化学反应反应,下列说法:①置换反应都是氧化还原反应,②复分解反应都不是氧化还原反应,③置换反应可能是氧化还原反应,④分解反应可能是氧化还原反应,⑤有单质参加的反应一定是氧化还原反应,其中正确的是( )
| A. | ①②③④ | B. | ①②③ | C. | ①②④ | D. | ③④⑤ |
20.在下列各组溶液中,离子一定能大量共存的是( )
| A. | 强碱性溶液中:Na+、K+、SO42-、AlO2- | |
| B. | 含有0.1 mol•L-1Fe3+的溶液中:K+、Mg2+、Cl-、SCN- | |
| C. | 某无色溶液中:NH4+、Fe2+、MnO4-、NO3- | |
| D. | 与铝反应生成H2的溶液中:Na+、K+、Cl-、SO42- |
17.要除去热水瓶中的水垢,可选用的试剂是( )
| A. | 食盐水 | B. | 烧碱溶液 | C. | 纯碱溶液 | D. | 稀醋酸 |
18.下列离子方程式正确的是( )
| A. | 水中加入钠:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 碳酸氢钙溶液加入盐酸:CO32-+2H+═CO2↑+H2O | |
| C. | 氢氧化铜中加入盐酸:OH-+H+═H2O | |
| D. | 碳酸镁跟稀硫酸反应:MgCO3+2H+═Mg2++H2O+CO2↑ |
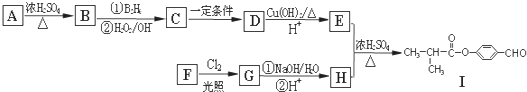
 .
. .E与H反应生成I的方程式为
.E与H反应生成I的方程式为 .
.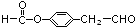 .
.