题目内容
4.将3.2g Cu与足量的浓硫酸在加热条件下充分反应.(1)被还原的硫酸的物质的量为0.05mol.
(2)把反应后的溶液稀释至500ml,取出50ml,向其中加入足量的BaCl2溶液,得到沉淀20.27g,则稀释后所得溶液中SO42-的物质的量浓度为1.74mol/L(保留两位小数).
(3)若浓硫酸中含溶质为a mol,投入足量的铜片并加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)<0.5amol.
(4)将产生的气体缓慢通入100ml b mol/L的氢氧化钠溶液中,若反应物均无剩余,则b的取值范围为0.5≤b≤1.
(5)讨论b的取值范围及与之对应的溶液的溶质及其物质的量,将结果填于下表中
| b的范围 | 溶质的种类 | 溶质的物质的量(mol) |
| 0.5 | NaHSO3 | 0.05 |
分析 (1)根据n=$\frac{m}{M}$计算出铜的物质的量,再结合反应方程式计算出被还原的硫酸的物质的量;
(2)2.33g沉淀为硫酸钡,根据n=$\frac{m}{M}$计算出硫酸钡的物质的量,再根据n=$\frac{n}{V}$计算出硫酸根离子的浓度;
(3)铜与浓硫酸的反应中,浓硫酸变成稀硫酸,反应停止,所以参加反应的硫酸越大小于溶液中总的硫酸,据此进行分析;
(4)根据铜的量计算出生成二氧化硫的物质的量,再结合反应生成亚硫酸钠、亚硫酸氢钠分别计算出b的值,从而得出其取值范围;
(5)当b=0.5时,氢氧化钠与二氧化硫恰好反应生成亚硫酸氢钠;
当b<0.5时,二氧化硫过量,反应生成的溶质为亚硫酸氢钠;
当b=1时,二者恰好反应生成亚硫酸钠,;
当0.5<b<1时,二氧化硫与氢氧化钠反应生成亚硫酸钠和亚硫酸氢钠的混合物;
当b>1时,氢氧化钠过量,反应生成亚硫酸钠和水,反应后溶质为亚硫酸钠和氢氧化钠的混合物,其中亚硫酸钠为0.05mol,据此结合反应方程式进行计算溶质的物质的量.
解答 解:(1)Cu与足量的浓硫酸在加热条件下充分反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2+2H2O,3.2g铜的物质的量为:$\frac{3.2g}{64g/mol}$=0.05mol,反应生成二氧化硫为0.05mol,而浓硫酸被还原生成二氧化硫,则被还原的硫酸的物质的量为0.05mol,
故答案为:0.05mol;
(2)20.27g硫酸钡的物质的量为:$\frac{20.27g}{233g/mol}$≈0.087mol,则稀释后溶液中硫酸根离子的物质的量为0.087mol,其浓度为:$\frac{0.087mol}{0.05L}$=1.74mol/L,
故答案为:1.74mol/L;
(3)若浓硫酸中含溶质amol,投入足量的铜片并加热,充分反应后,由于稀硫酸不与铜反应,则被还原的硫酸的物质的量一定小于0.5amol,
故答案为:<0.5a;
(4)3.2g铜的物质的量为:$\frac{3.2g}{64g/mol}$=0.05mol,根据反应方程式可知,0.05mol铜完全反应生成0.05mol二氧化硫,
100mL bmol•L-1的NaOH溶液中含有氢氧化钠的物质的量为:bmol/L×0.1L=0.1bmol,
当氢氧化钠与二氧化硫反应生成亚硫酸钠时,消耗氢氧化钠的物质的量为:0.1bmol=0.05mol×2,解得:b=1,
当二者反应生成亚硫酸氢钠时,消耗氢氧化钠的物质的量为:0.1bmol=0.05mol,解得:b=0.5,
所以b的范围为:0.5≤b≤1,
故答案为:0.5≤b≤1;
(5)当b=0.5时,氢氧化钠与二氧化硫恰好反应生成亚硫酸氢钠,生成的亚硫酸氢钠的物质的量=n(NaOH)=0.1bmol=0.05mol;
当b<0.5时,二氧化硫过量,反应生成的溶质为亚硫酸氢钠,生成的亚硫酸氢钠的物质的量=n(NaOH)=0.1bmol;
当b=1时,二者恰好反应生成亚硫酸钠,生成亚硫酸钠的物质的量为:0.05mol;
当0.5<b<1时,二氧化硫与氢氧化钠反应生成亚硫酸钠和亚硫酸氢钠的混合物,其中生成亚硫酸氢钠的物质的量为:(0.1-0.1b)mol,生成亚硫酸钠的物质的量为:(0.1b-0.05)mol;
当b>1时,氢氧化钠过量,反应生成亚硫酸钠和水,反应后溶质为亚硫酸钠和氢氧化钠的混合物,其中亚硫酸钠为0.05mol,剩余的氢氧化钠为:0.1bmol-0.05mol×2=(0.1b-0.1)mol,
故答案为:
| b的范围 | 溶质的种类 | 溶质的物质的量(mol) |
| <0.5 | NaHSO3 | 0.1b |
| 0.5 | NaHSO3 | 0.05 |
| 0.5~1 | NaHSO3Na2SO3 | NaHSO3:0.1-0.1b Na2SO3:0.1b-0.05 |
| 1 | Na2SO3 | 0.05 |
| >1 | Na2SO3 NaOH | Na2SO3:0.05 NaOH:0.1b-0.1 |
点评 本题考查了有关范围讨论的化学计算,题目难度较大,试题知识点较多、计算量较大,充分考查学生的分析、理解能力及化学计算能力,注意掌握讨论法在化学计算中的应用方法.

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案| A. | CH4O和C2H4O2 | B. | C8H10和C4H10 | C. | C2H4和C2H4O | D. | C8H8和C4H8O3 |
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | MgO的熔点很高,可用于制作耐高温材料 | |
| D. | 电解AlCl3饱和溶液,可制得金属铝 |
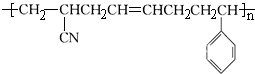 ,以下与此高分子材料相关的说法正确的是( )
,以下与此高分子材料相关的说法正确的是( )| A. | 合成该高分子材料的反应是缩聚反应 | |
| B. | 该高分子材料是由三种单体聚合而成的 | |
| C. | 合成该高分子材料的部分单体不能使溴水和酸性高锰酸钾溶液褪色 | |
| D. | 该高分子材料是体型结构高分子,具有热固性 |
| A. | Na+、K+、SO42-、HCO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Fe3+、K+、SO42-、Cl- | D. | Na+、K+、Cl-、NO3- |
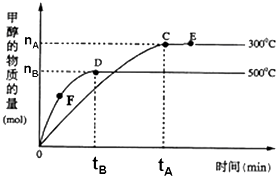 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g)?CH3OH(g),根据题意,以下说法正确的是( )
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g)?CH3OH(g),根据题意,以下说法正确的是( )| A. | 正反应的△H<0 | |
| B. | 容器中气体的总物质的量E点大于D点 | |
| C. | F点的正反应速率大于逆反应速率 | |
| D. | v(甲醇)=$\frac{{n}_{B}}{3{t}_{B}}$mol/(L•min)表示500℃时反应在D点的速率 |
| A. | ①②③④ | B. | ①②③ | C. | ①②④ | D. | ③④⑤ |
| A. | 与溴水发生取代,反应产物的结构简式是CH3CBr2CH3 | |
| B. | 一定条件下能与水加成,产物是混合物 | |
| C. | 一定条件下能加聚合成 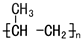 | |
| D. | 丙烯能使酸性高锰酸钾溶液褪色 |
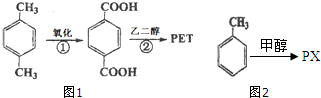 对二甲苯(英文名称p-xylene,缩写为PX)是一种低毒化合物,也是聚酯工业的重要原料,主要用于生产对苯二甲酸(PTA),对苯二甲酸再和乙二醇(EG)反应生成聚对苯二甲酸乙二醇酯(PET).国内对二甲苯产量增长步伐放缓,供应缺口加大,近一半的PX依靠进口.以PX为主要原料生产PET的一种路线如图1:
对二甲苯(英文名称p-xylene,缩写为PX)是一种低毒化合物,也是聚酯工业的重要原料,主要用于生产对苯二甲酸(PTA),对苯二甲酸再和乙二醇(EG)反应生成聚对苯二甲酸乙二醇酯(PET).国内对二甲苯产量增长步伐放缓,供应缺口加大,近一半的PX依靠进口.以PX为主要原料生产PET的一种路线如图1: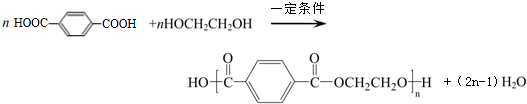 .(不用注明条件)
.(不用注明条件)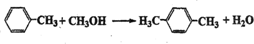 .(不用注明条件)
.(不用注明条件)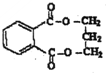 .
.