题目内容
1.某种合成药物中间体X的结构简式如图所示.下列说法正确的是( )
| A. | X分子中不存在手性碳原子 | |
| B. | 一定条件下,X可以发生加聚反应 | |
| C. | 1 mol X跟足量浓溴水反应,最多消耗1 mol Br2 | |
| D. | 1 mol X跟足量NaOH溶液反应,最多消耗3 mol NaOH |
分析 A.连接4个不同的原子或原子团的碳原子为手性碳原子;
B.碳碳不饱和键能发生加聚反应;
C.苯环上酚羟基邻对位氢原子能被溴原子取代;
D.酚羟基和羧基能和NaOH发生中和反应,氯原子能发生取代反应.
解答 解:A.连接4个不同的原子或原子团的碳原子为手性碳原子,X分子中不存在手性碳原子,故A正确;
B.碳碳不饱和键能发生加聚反应,该物质中不含碳碳不饱和键,所以不能发生加聚反应,故B错误;
C.苯环上酚羟基邻对位氢原子能被溴原子取代,1 mol X跟足量浓溴水反应,最多消耗2mol Br2,故C错误;
D.酚羟基和羧基能和NaOH发生中和反应,氯原子能发生取代反应,生成的HCl能和NaOH发生中和反应,所以1 mol X跟足量NaOH溶液反应,最多消耗5 mol NaOH,故D错误;
故选A.
点评 本题考查有机物结构和性质,明确官能团及其性质关系是解本题关键,侧重考查酚、卤代烃、羧酸的性质,易错选项是D.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
5.元素X和Y的原子序数都小于18,两者能组成化合物XY3.已知X的原子序数为n,则Y的原子序数不可能是( )
| A. | n+3 | B. | n-4 | C. | n-6 | D. | n-8 |
12.下列有关实验现象和解释或结论都正确的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
| B | 把浓硫酸滴到pH试纸上 | 试纸变红 | 浓硫酸具有酸性 |
| C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2?N2O4 的△H>0 |
| D | 铝箔在酒精灯火焰上加热 | 铝箔熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| A. | A | B. | B | C. | C | D. | D |
16.下列指定反应的离子方程式正确的是( )
| A. | 向FeCl3溶液中滴加HI溶液:Fe3++2I-═Fe2++I2 | |
| B. | 向AlCl3溶液中加入过量的氨水:Al3++4NH3•H2O═Al${{O}_{2}}^{-}$+4N${{H}_{4}}^{+}$+2H2O | |
| C. | 向稀NH4HCO3溶液中加入过量NaOH溶液:N${{H}_{4}}^{+}$+OH-═NH3•H2O | |
| D. | 向苯酚钠溶液中通入少量CO2: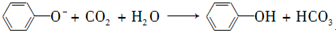 - - |
13.一种抗高血压的药物甲基多巴的结构简式如图所示,下列说法正确的是( )
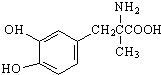

| A. | 1 mol甲基多巴的分子中含有4 mol双键 | |
| B. | 每个甲基多巴分子中含有一个手性碳原子 | |
| C. | 1 mol甲基多巴最多能与2 mol Br2发生取代反应 | |
| D. | 甲基多巴既能与盐酸反应,又能与氢氧化钠溶液反应 |
10.某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成.现进行如图所示实验.

下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 步骤Ⅰ中减少的3 g固体一定是混合物 | |
| B. | 步骤Ⅱ中质量减少的固体物质一定是Fe2O3 | |
| C. | 根据上述步骤Ⅱ可以得出蓝色溶液中n(Cu2+)=0.02 mol | |
| D. | 根据步骤Ⅰ、Ⅱ可以判断X中氧化铁的质量分数为50% |
11.原子序数依次增大的X、Y、Z、M、W为五种短周期元素.已知Y与Z、M与W分别同周期,X与M同主族;X、Z、M的质子数之和等于Y、W的质子数之和;X与Z、M与Z都可以分别形成A2B、A2B2型的化合物;X与Y形成的气态化合物在标准状况下的密度为0.76g•L-1;Y、M、W的最高价氧化物的水化物,两两间都能发生反应.下列说法正确的是( )
| A. | W的最高价氧化物和SiO2都是两性氧化物 | |
| B. | 只含X、Y、Z三种元素的某水溶液一定呈酸性 | |
| C. | 由X、M与Z形成的化合物X2Z2和M2Z2中所含的化学键类型相同 | |
| D. | M的单质可用于从钛、锆等金属的氯化物中制备钛、锆等单质 |
 .
.