题目内容
11.原子序数依次增大的X、Y、Z、M、W为五种短周期元素.已知Y与Z、M与W分别同周期,X与M同主族;X、Z、M的质子数之和等于Y、W的质子数之和;X与Z、M与Z都可以分别形成A2B、A2B2型的化合物;X与Y形成的气态化合物在标准状况下的密度为0.76g•L-1;Y、M、W的最高价氧化物的水化物,两两间都能发生反应.下列说法正确的是( )| A. | W的最高价氧化物和SiO2都是两性氧化物 | |
| B. | 只含X、Y、Z三种元素的某水溶液一定呈酸性 | |
| C. | 由X、M与Z形成的化合物X2Z2和M2Z2中所含的化学键类型相同 | |
| D. | M的单质可用于从钛、锆等金属的氯化物中制备钛、锆等单质 |
分析 原子序数依次增大的X、Y、Z、M、W为五种短周期元素.X与Y形成的气态化合物在标准状况下的密度为0.76g•L-1,则该气态化合物的相对分子质量=0.76×22.4=17,应为NH3,可推知X为H元素、Y为N元素;X与M同主族,M原子序数大于N元素,则M为Na;Y与Z同周期,X与Z、M与Z都可以分别形成A2B、A2B2型的化合物,则Z为O元素;M与W分别同周期,X、Z、M的质子数之和等于Y、W的质子数之和,则M、W原子序数相差1+8-7=2,可推知W为Al元素,Y、M、W的最高价氧化物的水化物,两两间都能发生反应,符合题意,据此解答.
解答 解:原子序数依次增大的X、Y、Z、M、W为五种短周期元素.X与Y形成的气态化合物在标准状况下的密度为0.76g•L-1,则该气态化合物的相对分子质量=0.76×22.4=17,应为NH3,可推知X为H元素、Y为N元素;X与M同主族,M原子序数大于N元素,则M为Na;Y与Z同周期,X与Z、M与Z都可以分别形成A2B、A2B2型的化合物,则Z为O元素;M与W分别同周期,X、Z、M的质子数之和等于Y、W的质子数之和,则M、W原子序数相差1+8-7=2,可推知W为Al元素,Y、M、W的最高价氧化物的水化物,两两间都能发生反应,符合题意,
A.W为Al元素,其氧化物具有两性,SiO2都是酸性氧化物,故A错误;
B.由H、N、O三种元素形成的某种化合物,硝酸溶液呈酸性,而一水合氨溶液为碱性,故B错误;
C.H2O2中只含有共价键,而Na2O2中含有共价键、离子键,所含的化学键类型不相同,故C错误;
D.Na的还原性很强,能从钛、锆等金属的氯化物中置换出钛、锆等单质,故D正确,
故选D.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,题目难度中等,侧重于学生的分析能力的考查,根据密度判断X与Y形成的气态化合物是氨气是推断的关键.

 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
| A. | X分子中不存在手性碳原子 | |
| B. | 一定条件下,X可以发生加聚反应 | |
| C. | 1 mol X跟足量浓溴水反应,最多消耗1 mol Br2 | |
| D. | 1 mol X跟足量NaOH溶液反应,最多消耗3 mol NaOH |
| A. | 向含有等物质的量的Ba(OH)2、KOH、的混合溶液中通入CO2;与CO2反应的物质依次是KOH、Ba(OH)2、BaCO3 | |
| B. | 向含有等物质的量的Fe2+、Ag+、Cu2+ 的混合溶液中加入Zn:与Zn反应的离子依次是Ag+、Cu2+、Fe2+ | |
| C. | 向含有等物质的量的AlO2?、OH-、CO32- 的混合溶液中滴加盐酸:与盐酸反应的物质依次是AlO2-、Al(OH)3、OH-、CO32- | |
| D. | 向含有等物质的量的AlCl3、HCl的混合溶液中滴加NaOH溶液,与NaOH反应的物质依次是AlCl3、HCl、Al(OH)3 |
| A. | 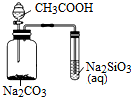 不能用来检验CH3COOH、H2CO3、H2SiO3酸性的强弱 | |
| B. | 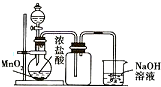 可用来制取并收集氯气 | |
| C. | 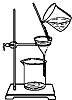 可用来分离氢氧化铁胶体中的胶体粒子 | |
| D. | 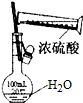 可用来配制一定物质的量浓度的稀硫酸 |
| A. | 每消耗1molCH4可以向外电路转移4mol电子 | |
| B. | 负极上CH4失去电子,电极反应式为CH4+10OH--8e-═CO32-+7H2O | |
| C. | 负极上是O2获得电子,电极反应式为:O2+2H2O+4e-═4OH- | |
| D. | 电池放电后,溶液pH不断升高 |
| A. | 电解过程产生的气体体积(在标准状况下)为5.6 L | |
| B. | 电解过程只发生了2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4 | |
| C. | 电解过程转移的电子数为3.612×1023个 | |
| D. | 加入的碱式碳酸铜的反应是:Cu2(OH)2CO3+2H2SO4═2CuSO4+CO2↑+3H2O |
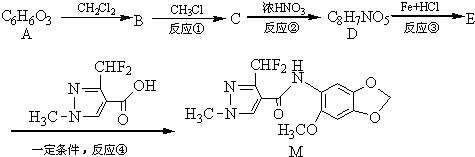
 ;A的名称(系统命名)是1,2,4-苯三酚.
;A的名称(系统命名)是1,2,4-苯三酚.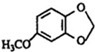 +HNO3(浓)$\stackrel{0℃-5℃}{→}$
+HNO3(浓)$\stackrel{0℃-5℃}{→}$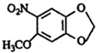 +H2O;反应①和②的先后次序不能颠倒,其原因是B中有酚羟基,若硝化,会被硝酸氧化而降低M的产率.
+H2O;反应①和②的先后次序不能颠倒,其原因是B中有酚羟基,若硝化,会被硝酸氧化而降低M的产率.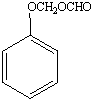 .
.
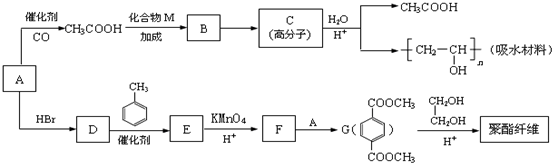
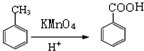
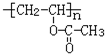 ,M的结构简式是HC≡CH,
,M的结构简式是HC≡CH,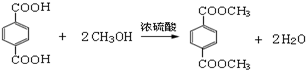 .
.