题目内容
6.氧化锌(ZnO)、氮化镓(GaN)及新型多相催化剂组成的纳米材料能利用可见光分解水,生成氢气和氧气.(1)Zn2+基态核外电子排布式为1s22s22p63s23p63d10或[Ar]3d10 .
(2)与水分子互为等电子体的一种阴离子是NH2-(填化学式).
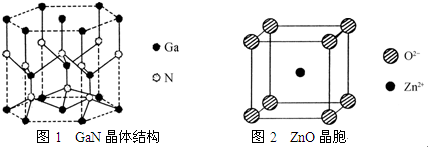
(3)氮化镓(GaN)的晶体结构如图1所示,其中氮原子的杂化轨道类型是sp3;N、Ga原子之间存在配位键,该配位键中提供电子对的原子是N.
(4)ZnO是两性氧化物,能跟强碱溶液反应生成[Zn(OH)4]2-. 不考虑空间构型,[Zn(OH)4]2-的结构可用示意图表示为
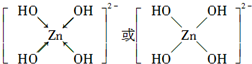 .
.(5)某种ZnO晶体的晶胞如图2所示,与O2-距离最近的Zn2+有8个.
分析 (1)Zn是30号元素,其原子核外有30个电子,失去两个电子生成锌离子,根据构造原理书写其核外电子排布式;
(2)原子个数相等、价层电子数相等的微粒互为等电子体;
(3)根据价层电子对互斥理论判断N原子杂化方式,含有孤电子对的原子和含有空轨道的原子之间易形成配位键;
(4)Zn原子和OH中O原子之间形成配位键;
(5)该晶胞中与O2-距离最近的Zn2+有8个.
解答 解:(1)Zn是30号元素,其原子核外有30个电子,失去最外层两个电子生成锌离子,根据构造原理书写其核外电子排布式为1s22s22p63s23p63d10或[Ar]3d10 ,故答案为:1s22s22p63s23p63d10或[Ar]3d10 ;
(2)与水分子互为等电子体的阴离子有NH2-,故答案为:NH2-;
(3)根据图知,每个N原子连接4个Ga原子,所以N原子价层电子对个数是4,则N原子采用sp3杂化,N原子含有孤电子对、Ga原子含有空轨道,所以N原子提供孤电子对,
故答案为:sp3;N;
(4)Zn原子和OH中O原子之间形成配位键,其表示为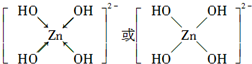 ,故答案为:
,故答案为: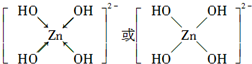 ;
;
(5)根据图知,每个晶胞中含有一个锌离子,每个氧离子被8个晶胞占有,所以与O2-距离最近的Zn2+有8个,故答案为:8.
点评 本题考查物质结构和性质,涉及晶胞计算、配位键、原子核外电子排布等知识点,同时考查学生空间想象能力及计算能力,知道配位键的表示方法,难点是配位数的计算,题目难度中等.

练习册系列答案
相关题目
10.第三周期R元素的原子,其次外层的电子数为最外层电子数的2倍,则R是( )
| A. | Li | B. | S | C. | Si | D. | P |
17.设NA表示阿伏伽德罗常数的数值,下列叙述正确的是( )
| A. | 25℃时,pH=13的1LBa(OH)2溶液中含有OH-数目为0.2NA | |
| B. | 标准状况下,1.12LNO与1.12LO2的混合物中含有的原子数为0.2NA | |
| C. | 常温下,4.6g乙醇含有C-H键总数为0.6NA | |
| D. | 常温下,1L0.1mol•L-1的NH4NO3溶液中氧原子数为0.3NA |
14.下列实验方法或装置正确的是( )
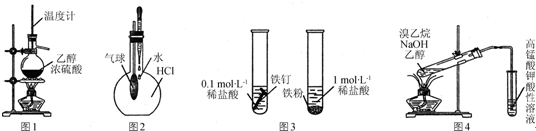

| A. | 用图1所示装置制取乙烯 | |
| B. | 用图2所示方法验证HCl气体易溶于水 | |
| C. | 用图3所示方法探究固体表面积对反应速率的影响 | |
| D. | 用图4所示方法检验溴乙烷与NaOH醇溶液共热产生乙烯 |
1.某种合成药物中间体X的结构简式如图所示.下列说法正确的是( )


| A. | X分子中不存在手性碳原子 | |
| B. | 一定条件下,X可以发生加聚反应 | |
| C. | 1 mol X跟足量浓溴水反应,最多消耗1 mol Br2 | |
| D. | 1 mol X跟足量NaOH溶液反应,最多消耗3 mol NaOH |
11.已知:2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H1
2CO(g)+O2(g)═2CO2(g)△H2
2H2(g)+O2(g)═2H2O(l)△H3
2H2(g)+O2(g)═2H2O(g)△H4
CO(g)+2H2(g)═CH3OH(g)△H5
下列关于上述反应焓变的判断正确的是( )
2CO(g)+O2(g)═2CO2(g)△H2
2H2(g)+O2(g)═2H2O(l)△H3
2H2(g)+O2(g)═2H2O(g)△H4
CO(g)+2H2(g)═CH3OH(g)△H5
下列关于上述反应焓变的判断正确的是( )
| A. | △H1>0,△H2<0 | B. | △H3>△H4 | ||
| C. | △H1=△H2+2△H3-△H5 | D. | 2△H5+△H1<0 |
15.下列反应的离子方程式正确的是( )
| A. | 过氧化钠固体与水反应制氧气:2O22-+2H2O=4OH-+O2↑ | |
| B. | 在100ml浓度为1 mol•L-1 的Fe(NO3)3的溶液中通入足量SO22Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| C. | 1mo•L-1 的 NaAlO2 溶液和2.5mol•L-1 的盐酸等体积混合:2AlO2-+5 H+=Al(OH)3↓+Al3++H2 O | |
| D. | 向碳酸钠溶液中逐滴加入与之等体积等物质的量浓度的稀醋酸:CO32-+H+═HCO3- |
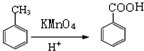
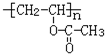 ,M的结构简式是HC≡CH,
,M的结构简式是HC≡CH,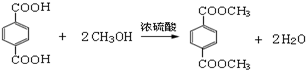 .
.