题目内容
12.下列有关实验现象和解释或结论都正确的是( )| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
| B | 把浓硫酸滴到pH试纸上 | 试纸变红 | 浓硫酸具有酸性 |
| C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2?N2O4 的△H>0 |
| D | 铝箔在酒精灯火焰上加热 | 铝箔熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.SO2通入紫色石蕊试液,溶液变红;
B.浓硫酸滴到pH试纸,试纸变黑;
C.充满NO2的密闭玻璃球浸泡在热水中,颜色加深,说明升高温度平衡向生成二氧化氮的方向移动;
D.铝箔在酒精灯火焰上加热,铝箔熔化但不滴落,因氧化铝的熔点高.
解答 解:A.SO2通入紫色石蕊试液,溶液变红,与二氧化硫为酸性氧化物的性质有关,故A错误;
B.浓硫酸滴到pH试纸,试纸变黑,与浓硫酸的脱水性有关,故B错误;
C.充满NO2的密闭玻璃球浸泡在热水中,颜色加深,说明升高温度平衡向生成二氧化氮的方向移动,则2NO2?N2O4的△H<0,故C错误;
D.铝箔在酒精灯火焰上加热,铝箔熔化但不滴落,因氧化铝的熔点高,包裹在Al的外面不使其滴落,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的性质、化学平衡等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
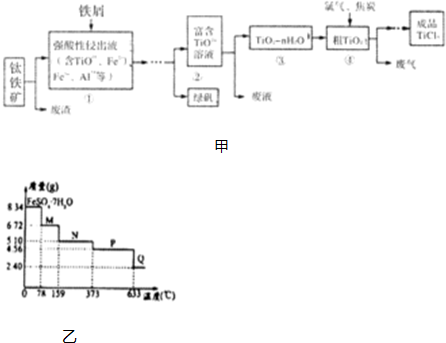
16. 汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气:
汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气:
2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.
(1)已知2molNO完全转化放出akJ热量,若将2molNO 和2molCO放入容器中反应,放出0.8akJ热量,则产生N2的物质的量为0.8mol.
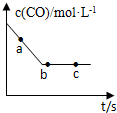
(2)一定条件下,在容积固定的容器中进行上述反应,CO浓度与时间关系如图所示:
①则反应速率υ(a)、υ(b)、υ(c)的大小关系是υ(a)>υ(b)=υ(c)
②下列可说明反应到达图中c点的是BC
A.NO、CO、CO2、N2的浓度比值保持2:2:2:1不变
B.CO的浓度不再改变
C.反应消耗2molNO的同时消耗1molN2
(3)为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
【资料查阅】
A.不同的催化剂对同一反应的催化效率不同;
B.使用等质量相同的催化剂时,催化剂的比表面积对催化效率有影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
①实验编号Ⅱ的实验目的为探究催化剂比表面积对反应速率的影响.
【结论】
②由表中数据可知,升高温度,反应速率将增大.(填“增大”、“减小”、“无影响”).
 汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气:
汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.
(1)已知2molNO完全转化放出akJ热量,若将2molNO 和2molCO放入容器中反应,放出0.8akJ热量,则产生N2的物质的量为0.8mol.
(2)一定条件下,在容积固定的容器中进行上述反应,CO浓度与时间关系如图所示:
①则反应速率υ(a)、υ(b)、υ(c)的大小关系是υ(a)>υ(b)=υ(c)
②下列可说明反应到达图中c点的是BC
A.NO、CO、CO2、N2的浓度比值保持2:2:2:1不变
B.CO的浓度不再改变
C.反应消耗2molNO的同时消耗1molN2
(3)为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
【资料查阅】
A.不同的催化剂对同一反应的催化效率不同;
B.使用等质量相同的催化剂时,催化剂的比表面积对催化效率有影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积 m2/g | 达平衡时所用的时间min |
| Ⅰ | 参照实验 | 280 | 6.50×10-3 | 4.00×10-3 | 80 | t |
| Ⅱ | 280 | 6.50×10-3 | 4.00×10-3 | 120 | 0.5t | |
| Ⅲ | 探究温度对反应速率的影响 | 360 | 6.50×10-3 | 4.00×10-3 | 80 | 0.2t |
【结论】
②由表中数据可知,升高温度,反应速率将增大.(填“增大”、“减小”、“无影响”).
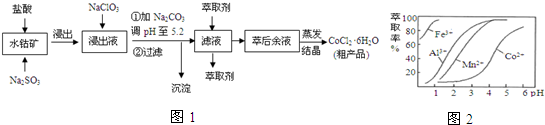
3.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2•6H2O的工艺流程如图1:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出浸出液加入NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O
(3)加Na2CO3调pH至5.2所得沉淀为Fe(OH)3、Al(OH)3.
(4)萃取剂对金属离子的萃取率与pH的关系如图2.萃取剂的作用是除去溶液中的Mn2+;其使用的较适宜pH范围是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质 量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)写出浸出液加入NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O
(3)加Na2CO3调pH至5.2所得沉淀为Fe(OH)3、Al(OH)3.
(4)萃取剂对金属离子的萃取率与pH的关系如图2.萃取剂的作用是除去溶液中的Mn2+;其使用的较适宜pH范围是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质 量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
17.设NA表示阿伏伽德罗常数的数值,下列叙述正确的是( )
| A. | 25℃时,pH=13的1LBa(OH)2溶液中含有OH-数目为0.2NA | |
| B. | 标准状况下,1.12LNO与1.12LO2的混合物中含有的原子数为0.2NA | |
| C. | 常温下,4.6g乙醇含有C-H键总数为0.6NA | |
| D. | 常温下,1L0.1mol•L-1的NH4NO3溶液中氧原子数为0.3NA |
4.某有机物的结构简式为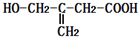 ,该有机物不可能发生的化学反应是( )
,该有机物不可能发生的化学反应是( )
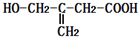 ,该有机物不可能发生的化学反应是( )
,该有机物不可能发生的化学反应是( )| A. | 还原 | B. | 水解 | C. | 氧化 | D. | 取代 |
1.某种合成药物中间体X的结构简式如图所示.下列说法正确的是( )


| A. | X分子中不存在手性碳原子 | |
| B. | 一定条件下,X可以发生加聚反应 | |
| C. | 1 mol X跟足量浓溴水反应,最多消耗1 mol Br2 | |
| D. | 1 mol X跟足量NaOH溶液反应,最多消耗3 mol NaOH |
2.在复杂体系中,确定化学反应的先后顺序有利于解决问题,对下列各种操作所涉及的反应先后顺序的判断合理的是( )
| A. | 向含有等物质的量的Ba(OH)2、KOH、的混合溶液中通入CO2;与CO2反应的物质依次是KOH、Ba(OH)2、BaCO3 | |
| B. | 向含有等物质的量的Fe2+、Ag+、Cu2+ 的混合溶液中加入Zn:与Zn反应的离子依次是Ag+、Cu2+、Fe2+ | |
| C. | 向含有等物质的量的AlO2?、OH-、CO32- 的混合溶液中滴加盐酸:与盐酸反应的物质依次是AlO2-、Al(OH)3、OH-、CO32- | |
| D. | 向含有等物质的量的AlCl3、HCl的混合溶液中滴加NaOH溶液,与NaOH反应的物质依次是AlCl3、HCl、Al(OH)3 |