题目内容
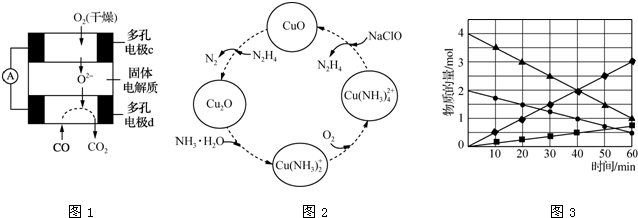
13.一种抗高血压的药物甲基多巴的结构简式如图所示,下列说法正确的是( )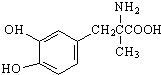
| A. | 1 mol甲基多巴的分子中含有4 mol双键 | |
| B. | 每个甲基多巴分子中含有一个手性碳原子 | |
| C. | 1 mol甲基多巴最多能与2 mol Br2发生取代反应 | |
| D. | 甲基多巴既能与盐酸反应,又能与氢氧化钠溶液反应 |
分析 该分子中含有酚羟基、羧基、氨基和苯环,具有酚、胺、羧酸和苯的性质,能发生取代反应、加成反应、还原反应、氧化反应、缩聚反应、酯化反应等,连接四个不同原子或原子团的碳原子为手性碳原子,据此分析解答.
解答 解:A.该分子中只存在C=O双键,所以1 mol甲基多巴的分子中含有1 mol双键,故A错误;
B.只有连接氨基的碳原子为手性碳原子,所以每个甲基多巴分子中含有一个手性碳原子,故B正确;
C.苯环上酚羟基邻对位氢原子能被溴原子取代,所以1 mol甲基多巴最多能与3mol Br2发生取代反应,故C错误;
D.含有氨基和羧基,所以具有两性,能和盐酸反应,又能与氢氧化钠溶液反应,故D正确;
故选BD.
点评 本题考查有机物结构和性质,明确官能团及其性质关系是解本题关键,侧重考查酚、氨基酸的性质,易错选项是C,注意酚发生取代反应的位置.

练习册系列答案
相关题目
3.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2•6H2O的工艺流程如图1:
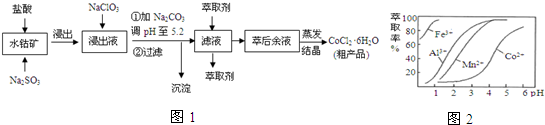
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出浸出液加入NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O
(3)加Na2CO3调pH至5.2所得沉淀为Fe(OH)3、Al(OH)3.
(4)萃取剂对金属离子的萃取率与pH的关系如图2.萃取剂的作用是除去溶液中的Mn2+;其使用的较适宜pH范围是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质 量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)写出浸出液加入NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O
(3)加Na2CO3调pH至5.2所得沉淀为Fe(OH)3、Al(OH)3.
(4)萃取剂对金属离子的萃取率与pH的关系如图2.萃取剂的作用是除去溶液中的Mn2+;其使用的较适宜pH范围是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质 量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
4.某有机物的结构简式为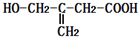 ,该有机物不可能发生的化学反应是( )
,该有机物不可能发生的化学反应是( )
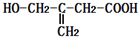 ,该有机物不可能发生的化学反应是( )
,该有机物不可能发生的化学反应是( )| A. | 还原 | B. | 水解 | C. | 氧化 | D. | 取代 |
1.某种合成药物中间体X的结构简式如图所示.下列说法正确的是( )


| A. | X分子中不存在手性碳原子 | |
| B. | 一定条件下,X可以发生加聚反应 | |
| C. | 1 mol X跟足量浓溴水反应,最多消耗1 mol Br2 | |
| D. | 1 mol X跟足量NaOH溶液反应,最多消耗3 mol NaOH |
8.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH<7的溶液中:S${{O}_{4}}^{2-}$、C${{O}_{3}}^{2-}$、Na+、K+ | |
| B. | 使酚酞变红色的溶液中:Na+、K+、Cl-、CH3COO- | |
| C. | 0.1 mol•L-1 NH4Al(SO4)2溶液中:Al${{O}_{2}}^{-}$、Mg2+、Cl-、S${{O}_{4}}^{2-}$ | |
| D. | $\frac{{c(H}^{+})}{{c(OH}^{-})}$=1012的溶液中:Na+、Ba2+、N${{O}_{3}}^{-}$、ClO- |
5.下列说法中,正确的是( )
| A. | AgI、AgCl与水混合后形成的分散系中:c(Ag+)=c(I-)>c(C1-) | |
| B. | 25℃时,在pH相等的NH4C1溶液和盐酸中,水的电离程度也相等 | |
| C. | 25℃时,将pH=11的NaOH溶液与pH=3的某弱酸HA的溶液等体积混合,混合后的溶液呈碱性 | |
| D. | 25℃时,在pH=2的H2C2O4 (一种二元弱酸)溶液与pH=12的NaOH溶液以任意比例混合后形成的溶液中,一定存在:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-) |
2.在复杂体系中,确定化学反应的先后顺序有利于解决问题,对下列各种操作所涉及的反应先后顺序的判断合理的是( )
| A. | 向含有等物质的量的Ba(OH)2、KOH、的混合溶液中通入CO2;与CO2反应的物质依次是KOH、Ba(OH)2、BaCO3 | |
| B. | 向含有等物质的量的Fe2+、Ag+、Cu2+ 的混合溶液中加入Zn:与Zn反应的离子依次是Ag+、Cu2+、Fe2+ | |
| C. | 向含有等物质的量的AlO2?、OH-、CO32- 的混合溶液中滴加盐酸:与盐酸反应的物质依次是AlO2-、Al(OH)3、OH-、CO32- | |
| D. | 向含有等物质的量的AlCl3、HCl的混合溶液中滴加NaOH溶液,与NaOH反应的物质依次是AlCl3、HCl、Al(OH)3 |
3.下列装置正确的是( )
| A. | 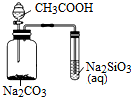 不能用来检验CH3COOH、H2CO3、H2SiO3酸性的强弱 | |
| B. | 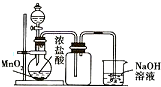 可用来制取并收集氯气 | |
| C. | 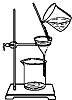 可用来分离氢氧化铁胶体中的胶体粒子 | |
| D. | 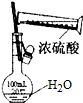 可用来配制一定物质的量浓度的稀硫酸 |