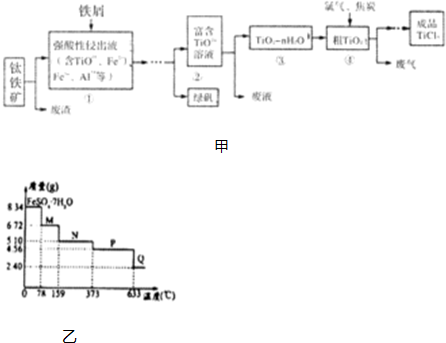
题目内容
16.下列指定反应的离子方程式正确的是( )| A. | 向FeCl3溶液中滴加HI溶液:Fe3++2I-═Fe2++I2 | |
| B. | 向AlCl3溶液中加入过量的氨水:Al3++4NH3•H2O═Al${{O}_{2}}^{-}$+4N${{H}_{4}}^{+}$+2H2O | |
| C. | 向稀NH4HCO3溶液中加入过量NaOH溶液:N${{H}_{4}}^{+}$+OH-═NH3•H2O | |
| D. | 向苯酚钠溶液中通入少量CO2: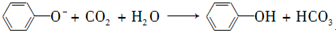 - - |
分析 A.电子、电荷不守恒;
B.反应生成氢氧化铝和氯化铵;
C.漏写碳酸氢根离子与碱的反应;
D.反应生成苯酚和碳酸氢钠.
解答 解:A.向FeCl3溶液中滴加HI溶液的离子反应为2Fe3++2I-═2Fe2++I2,故A错误;
B.向AlCl3溶液中加入过量的氨水的离子反应为Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故B错误;
C.向稀NH4HCO3溶液中加入过量NaOH溶液的离子反应为HCO3-+NH4++2OH-═NH3•H2O+CO32-+H2O,故C错误;
D.向苯酚钠溶液中通入少量CO2的离子反应为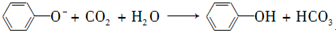 -,故D正确;
-,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,综合性较强,题目难度不大.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
20.一定温度下,在固定容积的密闭容器中发生下列反应:2HI(g)?H2(g)+I2(g).若HI浓度由0.1mol•L-1降到0.07mol•L-1时,需要15s,那么HI浓度由0.07mol•L-1降到0.05mol•L-1时,所需反应的时间为( )
| A. | 等于5 s | B. | 大于10 s | C. | 等于10 s | D. | 小于10 s |
4.某有机物的结构简式为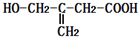 ,该有机物不可能发生的化学反应是( )
,该有机物不可能发生的化学反应是( )
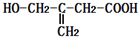 ,该有机物不可能发生的化学反应是( )
,该有机物不可能发生的化学反应是( )| A. | 还原 | B. | 水解 | C. | 氧化 | D. | 取代 |
11.科学家观测到固体催化剂表面“抓取”一氧化碳分子和氧原子配对生成二氧化碳分子的过程.下列关于碳的氧化物的说法正确的是( )
| A. | CO与CO2均为酸性氧化物 | B. | CO是煤气的主要成分之一 | ||
| C. | CO2是弱电解质 | D. | 大量CO2的排放可导致酸雨的形成 |
1.某种合成药物中间体X的结构简式如图所示.下列说法正确的是( )


| A. | X分子中不存在手性碳原子 | |
| B. | 一定条件下,X可以发生加聚反应 | |
| C. | 1 mol X跟足量浓溴水反应,最多消耗1 mol Br2 | |
| D. | 1 mol X跟足量NaOH溶液反应,最多消耗3 mol NaOH |
8.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH<7的溶液中:S${{O}_{4}}^{2-}$、C${{O}_{3}}^{2-}$、Na+、K+ | |
| B. | 使酚酞变红色的溶液中:Na+、K+、Cl-、CH3COO- | |
| C. | 0.1 mol•L-1 NH4Al(SO4)2溶液中:Al${{O}_{2}}^{-}$、Mg2+、Cl-、S${{O}_{4}}^{2-}$ | |
| D. | $\frac{{c(H}^{+})}{{c(OH}^{-})}$=1012的溶液中:Na+、Ba2+、N${{O}_{3}}^{-}$、ClO- |
5.下列说法中,正确的是( )
| A. | AgI、AgCl与水混合后形成的分散系中:c(Ag+)=c(I-)>c(C1-) | |
| B. | 25℃时,在pH相等的NH4C1溶液和盐酸中,水的电离程度也相等 | |
| C. | 25℃时,将pH=11的NaOH溶液与pH=3的某弱酸HA的溶液等体积混合,混合后的溶液呈碱性 | |
| D. | 25℃时,在pH=2的H2C2O4 (一种二元弱酸)溶液与pH=12的NaOH溶液以任意比例混合后形成的溶液中,一定存在:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-) |