题目内容
10.某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成.现进行如图所示实验.
下列有关说法正确的是( )
| A. | 步骤Ⅰ中减少的3 g固体一定是混合物 | |
| B. | 步骤Ⅱ中质量减少的固体物质一定是Fe2O3 | |
| C. | 根据上述步骤Ⅱ可以得出蓝色溶液中n(Cu2+)=0.02 mol | |
| D. | 根据步骤Ⅰ、Ⅱ可以判断X中氧化铁的质量分数为50% |
分析 9.4gX与过量的氢氧化钠溶液反应后得到6.4g不溶物,固体部分溶解,原固体中至少含有Al2O3、SiO2的一种物质;6.4g固体与过量的盐酸反应得到蓝色溶液,蓝色溶液中存在铜离子,发生了反应:Fe2O3+6H+═2Fe3++3H2O、Cu+2Fe3+═2Fe2++Cu2+,说明溶液中一定存在Fe2O3,1.92g固体为铜,据此进行判断.
解答 解:A.Al2O3、SiO2都能够与NaOH溶液反应,所以步骤I中减少的3g固体可能为氧化铝或二氧化硅,不一定为混合物,故A错误;
B.步骤II中发生了反应:Fe2O3+6H+═2Fe3++3H2O、Cu+2Fe3+═2Fe2++Cu2+,6.4g固体为铜和Fe2O3的混合物,减少的为铜和氧化铁,故B错误;
C.6.4g变成1.92g,质量减少:6.4g-1.92g=4.48g,减少的质量为Fe2O3和部分Cu,剩余的1.92g为铜,设铜的物质的量为x,根据反应Cu+2Fe3+═2Fe2++Cu2+可知氧化铁的物质的量也为x,则64x+160x=4.48,解得x=0.02mol,则反应后蓝色溶液中含有0.02mol铜离子,故C正确;
D.160g/mol×0.02mol=3.2g,X中氧化铁的质量分数为:$\frac{3.2g}{9.4g}$×100%=34.0%,故D错误;
故选C.
点评 本题考查混合物反应的计算,题目难度中等,注意掌握常见在的性质及检验方法,能够根据反应现象判断存在的物质,选项C为难点和易错点,注意合理分析题中数据,根据题中数据及反应方程式计算出铜和氧化铁的物质的量.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.某种合成药物中间体X的结构简式如图所示.下列说法正确的是( )


| A. | X分子中不存在手性碳原子 | |
| B. | 一定条件下,X可以发生加聚反应 | |
| C. | 1 mol X跟足量浓溴水反应,最多消耗1 mol Br2 | |
| D. | 1 mol X跟足量NaOH溶液反应,最多消耗3 mol NaOH |
5.下列说法中,正确的是( )
| A. | AgI、AgCl与水混合后形成的分散系中:c(Ag+)=c(I-)>c(C1-) | |
| B. | 25℃时,在pH相等的NH4C1溶液和盐酸中,水的电离程度也相等 | |
| C. | 25℃时,将pH=11的NaOH溶液与pH=3的某弱酸HA的溶液等体积混合,混合后的溶液呈碱性 | |
| D. | 25℃时,在pH=2的H2C2O4 (一种二元弱酸)溶液与pH=12的NaOH溶液以任意比例混合后形成的溶液中,一定存在:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-) |
15.下列反应的离子方程式正确的是( )
| A. | 过氧化钠固体与水反应制氧气:2O22-+2H2O=4OH-+O2↑ | |
| B. | 在100ml浓度为1 mol•L-1 的Fe(NO3)3的溶液中通入足量SO22Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| C. | 1mo•L-1 的 NaAlO2 溶液和2.5mol•L-1 的盐酸等体积混合:2AlO2-+5 H+=Al(OH)3↓+Al3++H2 O | |
| D. | 向碳酸钠溶液中逐滴加入与之等体积等物质的量浓度的稀醋酸:CO32-+H+═HCO3- |
2.在复杂体系中,确定化学反应的先后顺序有利于解决问题,对下列各种操作所涉及的反应先后顺序的判断合理的是( )
| A. | 向含有等物质的量的Ba(OH)2、KOH、的混合溶液中通入CO2;与CO2反应的物质依次是KOH、Ba(OH)2、BaCO3 | |
| B. | 向含有等物质的量的Fe2+、Ag+、Cu2+ 的混合溶液中加入Zn:与Zn反应的离子依次是Ag+、Cu2+、Fe2+ | |
| C. | 向含有等物质的量的AlO2?、OH-、CO32- 的混合溶液中滴加盐酸:与盐酸反应的物质依次是AlO2-、Al(OH)3、OH-、CO32- | |
| D. | 向含有等物质的量的AlCl3、HCl的混合溶液中滴加NaOH溶液,与NaOH反应的物质依次是AlCl3、HCl、Al(OH)3 |
20.有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成燃料电池.电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是( )
| A. | 每消耗1molCH4可以向外电路转移4mol电子 | |
| B. | 负极上CH4失去电子,电极反应式为CH4+10OH--8e-═CO32-+7H2O | |
| C. | 负极上是O2获得电子,电极反应式为:O2+2H2O+4e-═4OH- | |
| D. | 电池放电后,溶液pH不断升高 |
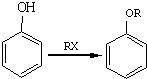
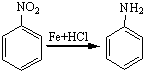
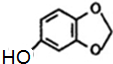 ;A的名称(系统命名)是1,2,4-苯三酚.
;A的名称(系统命名)是1,2,4-苯三酚.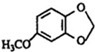 +HNO3(浓)$\stackrel{0℃-5℃}{→}$
+HNO3(浓)$\stackrel{0℃-5℃}{→}$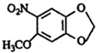 +H2O;反应①和②的先后次序不能颠倒,其原因是B中有酚羟基,若硝化,会被硝酸氧化而降低M的产率.
+H2O;反应①和②的先后次序不能颠倒,其原因是B中有酚羟基,若硝化,会被硝酸氧化而降低M的产率.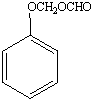 .
.