题目内容
9.A、B、C、D、E、F均属前四周期且原子序数依次增大的六种元素,其中A、B、C是同一周期相邻的三种元素,C的氢化物水溶液呈碱性; D的基态原子3p轨道上有3个未成对电子;E、F为副族元素,4s能级均只有一个电子.回答下列问题:(1)A、B、C三种元素按电负性由小到大的顺序是BCN或B<C<N(用元素符号表示).
(2)B与氧原子能形成四原子阴离子,其中B的杂化方式为sp2杂化;C的三氯化物分子的立体构型为三角锥形.
(3)任写一种与BC-离子互为等电子体的离子C22-或O22+(写出化学式).
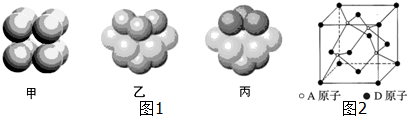
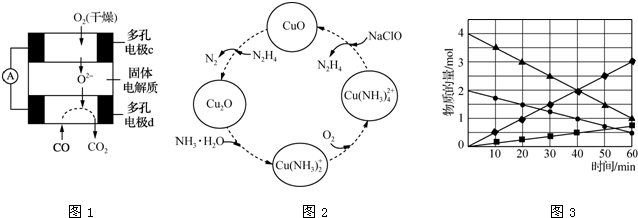
(4)F原子的外围电子排布式为3d104s1,F晶体中原子的堆积方式是图1中的丙 (填写“甲”、“乙”或“丙”).
(5)E的离子可以形成多种配合物,将ECl3溶液蒸发浓缩,析出深绿色晶体.该晶体中E3+、Cl-、H2O的物质的量之比为1:3:6,且E的配位数为6.向1.0mol该晶体的溶液中加入足量AgNO3溶液产生143.5g白色沉淀,则该配合物的化学式为[Cr(H2O)4Cl2]Cl•2H2O.
(6)AD是一种耐磨材料,其结构与金刚石相似,图2为其晶体结构单元,它可由A的三溴化物和D的三溴化物于高温下在氢气的氛围中合成.
①写出合成AD的化学方程式:BBr3+PBr3+3H2$\frac{\underline{\;高温\;}}{\;}$BP+6HBr.
②已知晶体中A与D原子的最近距离为a pm,则该晶体密度的表达式为$\frac{4×42}{{N}_{A}×(\frac{4}{\sqrt{3}}a×1{0}^{-10})^{3}}$g/cm3.(不需化简,阿伏加德罗常数为NA)
分析 A、B、C、D、E、F均属前四周期且原子序数依次增大的六种元素,其中A、B、C是同一周期相邻的三种元素,C的氢化物水溶液呈碱性,则C为N验算,结合原子序数大小可知B为C、A为B元素;D的基态原子3p轨道上有3个未成对电子,其核外电子排布式为1s22s22p63s23p3,故D为P元素;E、F为副族元素,4s能级均只有一个电子,核外电子排布式分别为:1s22s22p63s22p63d54s1、1s22s22p63s22p63d104s1,则E为Cr元素、F为Cu元素,据此进行解答(1)~(5);
(6)①高温下,B的三溴化物和P的三溴化物在氢气的氛围中合成BP,根据反应物、生成物及反应条件书写方程式;
②晶体中B与P原子的最近距离为anm,即a×10-7cm, ,图中1、2、3、4原子形成正四面体结构,这四个原子之间的B原子位于正四面体体心上,1、5原子之间的距离为a×10-7cm,顶点到体心距离与体心到底面距离之比为3:1,则其高为$\frac{4}{3}$×a×10-7cm,设1、2原子之间距离为x,1、2、3原子形成的正三角形底面的高=$\frac{\sqrt{3}}{2}$x,正三角形顶点到中心的距离与中心到底的距离之比为2:1,所以正三角形顶点到中心的距离=$\frac{\sqrt{3}}{2}$x×$\frac{2}{3}$=$\frac{\sqrt{3}}{3}$x,由1、2、5构成直角三角形中存在x2=($\frac{\sqrt{3}}{3}$x)2+($\frac{4}{3}$×a×10-7)2,x=$\frac{2\sqrt{6}}{3}$×a×10-7,则晶胞棱长=$\sqrt{\frac{(2x)^{2}}{2}}$cm=$\frac{4}{\sqrt{3}}a×1{0}^{-7}$cm,晶胞体积=($\frac{4}{\sqrt{3}}a×1{0}^{-7}$)3cm3,
,图中1、2、3、4原子形成正四面体结构,这四个原子之间的B原子位于正四面体体心上,1、5原子之间的距离为a×10-7cm,顶点到体心距离与体心到底面距离之比为3:1,则其高为$\frac{4}{3}$×a×10-7cm,设1、2原子之间距离为x,1、2、3原子形成的正三角形底面的高=$\frac{\sqrt{3}}{2}$x,正三角形顶点到中心的距离与中心到底的距离之比为2:1,所以正三角形顶点到中心的距离=$\frac{\sqrt{3}}{2}$x×$\frac{2}{3}$=$\frac{\sqrt{3}}{3}$x,由1、2、5构成直角三角形中存在x2=($\frac{\sqrt{3}}{3}$x)2+($\frac{4}{3}$×a×10-7)2,x=$\frac{2\sqrt{6}}{3}$×a×10-7,则晶胞棱长=$\sqrt{\frac{(2x)^{2}}{2}}$cm=$\frac{4}{\sqrt{3}}a×1{0}^{-7}$cm,晶胞体积=($\frac{4}{\sqrt{3}}a×1{0}^{-7}$)3cm3,
该晶胞中B原子个数为4、P原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,再根据密度=$\frac{m}{V}$计算.
解答 解:A、B、C、D、E、F均属前四周期且原子序数依次增大的六种元素,其中A、B、C是同一周期相邻的三种元素,C的氢化物水溶液呈碱性,则C为N验算,结合原子序数大小可知B为C、A为B元素;D的基态原子3p轨道上有3个未成对电子,其核外电子排布式为1s22s22p63s23p3,故D为P元素;E、F为副族元素,4s能级均只有一个电子,核外电子排布式分别为:1s22s22p63s22p63d54s1、1s22s22p63s22p63d104s1,则E为Cr元素、F为Cu元素,
(1)A、B、C分别为B、C、N,同一周期中,原子序数越大,电负性越小,则三种元素按电负性由小到大的顺序为:B C N或B<C<N,
故答案为:B C N或B<C<N;
(2)B为C元素,与氧元素形成的四原子阴离子为CO32-,CO32-离子中C原子价层电子对数=3+$\frac{4+2-2×3}{2}$=3,且C原子不含孤电子对,所以其空间构型为平面三角形,C原子采用sp2杂化;C为N元素,其三氯化物为NCl3,其分子中含有3个单键和1个孤对电子,其分子中N原子采用sp3杂化,分子的立体构型为三角锥形,
故答案为:sp2杂化;三角锥形;
(3)原子个数相等、价电子数相等的微粒互为等电子体,与CN-离子互为等电子体的有:C22-或O22+,
故答案为:C22-或O22+;
(4)F除最外层原子轨道处于半充满状态,其余能层均充满电子,为Cu,原子序数为29,原子核外电子排布为:1s22s22p63s23p63d104s1,外围电子排布式为:3d104s1,Cu晶体属于面心立方最密堆积,为ABC型排列方式,故图丙符合,
故答案为:3d104s1;丙;
(5)向1.0mol该晶体的溶液中加入足量AgNO3溶液产生143.5g白色沉淀,该白色沉淀为AgCl,其物质的量为:$\frac{143.5g}{143.5g/mol}$=1mol,说明在该化合物中含有1个氯离子,Cr3+、Cl-、H2O的物质的量之比为1:3:6,则配位离子中含有氯离子数为:3-1=2,配位离子中含有水为:6-2=4,则含有结晶水水的个数为:6-4=2,故该配位化合物的化学式为:[Cr(H2O)4Cl2]Cl•2H2O,
故答案为:[Cr(H2O)4Cl2]Cl•2H2O;
(6)①高温下,B的三溴化物和P的三溴化物在氢气的氛围中合成BP,根据反应物、生成物及反应条件书写方程式为BBr3+PBr3+3H2$\frac{\underline{\;高温\;}}{\;}$BP+6HBr,
故答案为:BBr3+PBr3+3H2$\frac{\underline{\;高温\;}}{\;}$BP+6HBr;
②晶体中B与P原子的最近距离为apm,即a×10-7cm, ,图中1、2、3、4原子形成正四面体结构,这四个原子之间的B原子位于正四面体体心上,1、5原子之间的距离为a×10-7cm,顶点到体心距离与体心到底面距离之比为3:1,则其高为$\frac{4}{3}$×a×10-7cm,设1、2原子之间距离为x,1、2、3原子形成的正三角形底面的高=$\frac{\sqrt{3}}{2}$x,正三角形顶点到中心的距离与中心到底的距离之比为2:1,所以正三角形顶点到中心的距离=$\frac{\sqrt{3}}{2}$x×$\frac{2}{3}$=$\frac{\sqrt{3}}{3}$x,由1、2、5构成直角三角形中存在:x2=($\frac{\sqrt{3}}{3}$x)2+($\frac{4}{3}$×a×10-7)2,解得:x=$\frac{2\sqrt{6}}{3}$×a×10-7,则晶胞棱长=$\sqrt{\frac{(2x)^{2}}{2}}$cm=$\frac{4}{\sqrt{3}}a×1{0}^{-7}$cm,晶胞体积=($\frac{4}{\sqrt{3}}a×1{0}^{-7}$)3cm3,
,图中1、2、3、4原子形成正四面体结构,这四个原子之间的B原子位于正四面体体心上,1、5原子之间的距离为a×10-7cm,顶点到体心距离与体心到底面距离之比为3:1,则其高为$\frac{4}{3}$×a×10-7cm,设1、2原子之间距离为x,1、2、3原子形成的正三角形底面的高=$\frac{\sqrt{3}}{2}$x,正三角形顶点到中心的距离与中心到底的距离之比为2:1,所以正三角形顶点到中心的距离=$\frac{\sqrt{3}}{2}$x×$\frac{2}{3}$=$\frac{\sqrt{3}}{3}$x,由1、2、5构成直角三角形中存在:x2=($\frac{\sqrt{3}}{3}$x)2+($\frac{4}{3}$×a×10-7)2,解得:x=$\frac{2\sqrt{6}}{3}$×a×10-7,则晶胞棱长=$\sqrt{\frac{(2x)^{2}}{2}}$cm=$\frac{4}{\sqrt{3}}a×1{0}^{-7}$cm,晶胞体积=($\frac{4}{\sqrt{3}}a×1{0}^{-7}$)3cm3,
该晶胞中B原子个数为4、P原子个数为:8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,
所以该晶胞密度为:$\frac{m}{V}$=$\frac{\frac{M}{{N}_{A}}×4}{V}$=$\frac{\frac{42}{{N}_{A}}×4}{(\frac{4}{\sqrt{3}}{×a×1{0}^{-7})}^{3}}$g/cm3=$\frac{4×42}{{N}_{A}×(\frac{4}{\sqrt{3}}a×1{0}^{-10})^{3}}$g/cm3,
故答案为:$\frac{4×42}{{N}_{A}×(\frac{4}{\sqrt{3}}a×1{0}^{-10})^{3}}$.
点评 本题考查了位置结构与性质关系的综合应用、晶胞的计算,题目难度较大,注意熟练掌握原子结构与元素周期表、元素周期律的关系,推断元素为解答关键,(6)中晶胞计算为难点、易错点,注意掌握晶胞计算的方法与技巧,试题培养了学生的分析、理解能力及化学计算能力.

 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案| A. | NH4+、Fe2+、NO3-、H+ | B. | K+、Mg2+、I-、ClO- | ||
| C. | K+、Ba2+、Cl-、Br- | D. | K+、HCO3-、Cl-、H+ |
| A. | 25℃时,pH=13的1LBa(OH)2溶液中含有OH-数目为0.2NA | |
| B. | 标准状况下,1.12LNO与1.12LO2的混合物中含有的原子数为0.2NA | |
| C. | 常温下,4.6g乙醇含有C-H键总数为0.6NA | |
| D. | 常温下,1L0.1mol•L-1的NH4NO3溶液中氧原子数为0.3NA |
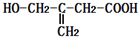 ,该有机物不可能发生的化学反应是( )
,该有机物不可能发生的化学反应是( )| A. | 还原 | B. | 水解 | C. | 氧化 | D. | 取代 |
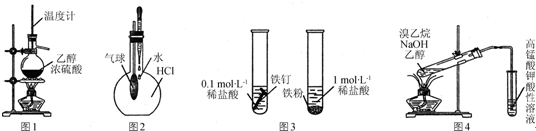
| A. | 用图1所示装置制取乙烯 | |
| B. | 用图2所示方法验证HCl气体易溶于水 | |
| C. | 用图3所示方法探究固体表面积对反应速率的影响 | |
| D. | 用图4所示方法检验溴乙烷与NaOH醇溶液共热产生乙烯 |

| A. | X分子中不存在手性碳原子 | |
| B. | 一定条件下,X可以发生加聚反应 | |
| C. | 1 mol X跟足量浓溴水反应,最多消耗1 mol Br2 | |
| D. | 1 mol X跟足量NaOH溶液反应,最多消耗3 mol NaOH |
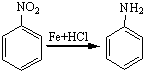
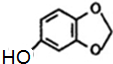 ;A的名称(系统命名)是1,2,4-苯三酚.
;A的名称(系统命名)是1,2,4-苯三酚.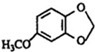 +HNO3(浓)$\stackrel{0℃-5℃}{→}$
+HNO3(浓)$\stackrel{0℃-5℃}{→}$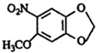 +H2O;反应①和②的先后次序不能颠倒,其原因是B中有酚羟基,若硝化,会被硝酸氧化而降低M的产率.
+H2O;反应①和②的先后次序不能颠倒,其原因是B中有酚羟基,若硝化,会被硝酸氧化而降低M的产率.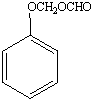 .
.