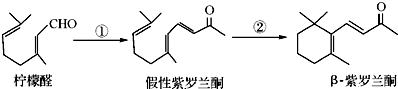
题目内容
8. W、X、Y、Z(W、X、Y、Z分别代表元素符号)均为元素周期表中前四周期的元素,其原子序数依次增大,其中W、X、Y为短周期元素,它们的单质在通常状况下均为无色气体.X元素的基态原子在同周期元素基态原子中含有的未成对电子数最多,Y元素的基态原子中s能级上的电子数等于p能级上的电子数,Z为金属元素,其基态原子是具有4s1结构的基态原子中质子数最多的原子,试回答下列各题:
W、X、Y、Z(W、X、Y、Z分别代表元素符号)均为元素周期表中前四周期的元素,其原子序数依次增大,其中W、X、Y为短周期元素,它们的单质在通常状况下均为无色气体.X元素的基态原子在同周期元素基态原子中含有的未成对电子数最多,Y元素的基态原子中s能级上的电子数等于p能级上的电子数,Z为金属元素,其基态原子是具有4s1结构的基态原子中质子数最多的原子,试回答下列各题:(1)写出X的基态原子的核外电子排布式1s22s22p3;
(2)比较X、Y两元素基态原子的第一电离能大小:X>Y(填“>”、“<”或“=”),理由是氮原子2p能级为半满结构,该结构相对稳定,难以失去电子;
(3)W、X两元素能形成一种常见气体M,每个M分子中含有l0个电子,M分子中心原子的杂化方式为sp3;W、X两种元素还能形成一种常见阳离子N,每个N中也含有10个电子,但在N与M中所含化学键的键角大小不同,其原因是两微粒虽中心原子杂化方式相同,但是由于氨分子存在一对孤对电子,其占据氮原子核外空间较大,对成键电子对排斥力强,所以使得氨分子中化学键的键角比铵根离子中的小;
(4)Z2+可与M分子在水溶液中形成[Z(M)4]2+,其中M分子和Z2+通过配位键结合;
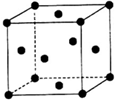
(5)单质Z的晶胞结构如图所示,则每个晶胞中含有原子Z的个数为4.
分析 W、X、Y、Z(W、X、Y、Z分别代表元素符号)均为元素周期表中前四周期的元素,其原子序数依次增大,其中W、X、Y为短周期元素,它们的单质在通常状况下均为无色气体;X元素的基态原子在同周期元素基态原子中含有的未成对电子数最多,则X的单质为氮气,X为N元素;Y元素的基态原子中s能级上的电子数等于p能级上的电子数,且Y的原子序数大于N元素,1s22s22p4或1s22s22p63s2,由于Y的单质为气体,则Y为O元素;X的原子序数小于N元素,且单质在常温下为气态、结合(3)能够形成化合物M,则X为H元素;Z为金属元素,其基态原子是具有4s1结构的基态原子中质子数最多的原子,则其核外电子排布式中的能层电子都已经排满,其基态原子的核外电子排布式为:1s22s22p63s23p63d104s1,则Z为Cu元素,据此进行解答.
解答 解:W、X、Y、Z(W、X、Y、Z分别代表元素符号)均为元素周期表中前四周期的元素,其原子序数依次增大,其中W、X、Y为短周期元素,它们的单质在通常状况下均为无色气体;X元素的基态原子在同周期元素基态原子中含有的未成对电子数最多,则X的单质为氮气,X为N元素;Y元素的基态原子中s能级上的电子数等于p能级上的电子数,且Y的原子序数大于N元素,1s22s22p4或1s22s22p63s2,由于Y的单质为气体,则Y为O元素;X的原子序数小于N元素,且单质在常温下为气态、结合(3)能够形成化合物M,则X为H元素;Z为金属元素,其基态原子是具有4s1结构的基态原子中质子数最多的原子,则其核外电子排布式中的能层电子都已经排满,其基态原子的核外电子排布式为:1s22s22p63s23p63d104s1,则Z为Cu元素,
(1)X为N元素,其原子序数为7,其基态原子核外电子排布式为:1s22s22p3,故答案为:1s22s22p3 ;
(2)由于N原子2p能级为半满结构,该结构相对稳定,难以失去电子,所以N原子的第一电离能大于O原子,
故答案为:>;氮原子2p能级为半满结构,该结构相对稳定,难以失去电子;
(3)W、X两元素能形成一种常见气体M,每个M分子中含有l0个电子,则M为氨气,氨气分子中含有3个氮氢键和一对孤对电子,则氨气的中心原子N原子采用sp3杂化;W、X两种元素还能形成一种常见阳离子N,每个N中也含有10个电子,则N为铵根离子,由于两微粒虽中心原子杂化方式相同,但是由于氨分子存在一对孤对电子,其占据氮原子核外空间较大,对成键电子对排斥力强,所以使得氨分子中化学键的键角比铵根离子中的小,
故答案为:sp3;两微粒虽中心原子杂化方式相同,但是由于氨分子存在一对孤对电子,其占据氮原子核外空间较大,对成键电子对排斥力强,所以使得氨分子中化学键的键角比铵根离子中的小;
(4)Cu2+可以与NH3形成配合物,其中NH3中N提供孤对电子,Cu2+提供空轨道,而形成配位键,故答案为:配位键;
(5)Z为Cu元素,在每个顶点和面上分别含有1个铜原子,根据均摊法,每个晶胞中铜原子个数为8×$\frac{1}{8}$+$\frac{1}{2}$×6=4,故答案为:4.
点评 本题考查了位置、结构与性质关系的应用,题目难度中等,正确推断各元素为解答关键,注意熟练掌握原子结构与元素周期表、元素周期律的关系,(3)为易错点,注意从氨气分子中的孤对电子对成键电子对的斥力角度分析,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.


| A. | 图1表示相同温度下,相同体积、pH均为1的盐酸和醋酸溶液分别加水稀释时溶液pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强 | |
| B. | 图2表示CH3COOH溶液中逐步加CH3COONa固体后,溶液pH的变化 | |
| C. | 图3表示某可逆反应正、逆反应速率随温度变化,则该反应的正反应是吸热反应 | |
| D. | 图4表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)???N2O4(g),相同时间后测得NO2体积分数的曲线,则该反应的正反应△H<0 |
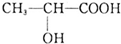 ,下列有关乳酸的说法中,不正确的是( )
,下列有关乳酸的说法中,不正确的是( )| A. | 乳酸中能发生酯化反应的官能团有2种 | |
| B. | 1 mol乳酸可与2 mol NaOH发生中和反应 | |
| C. | 1 mol乳酸与足量金属Na反应生成1 mol H2 | |
| D. | 有机物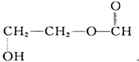 与乳酸互为同分异构体 与乳酸互为同分异构体 |
| A. | 蛋白质在空气中完全燃烧转化为水和二氧化碳 | |
| B. | 汽油、甘油、花生油都属于酯类物质 | |
| C. | 麦芽糖及其水解产物均能发生银镜反应 | |
| D. | 燃煤产生的二氧化硫是引起雾霾的主要原因 |
| A. | KAl(SO4)2溶液:c(SO42-)>c(K+)=c(Al3+)>c(H+)>c(OH-) | |
| B. | 用酚酞作指示剂,向氨水中滴入标准盐酸至滴定终点:c(NH4+)<c(Cl-) | |
| C. | NH4Cl与Ba(NO3)2的混合溶液:c(Cl-)+2c(NO3-)=c(NH4+)+c(NH3•H2O)+c(Ba2+) | |
| D. | 饱和氯水中:c(H+)=2c(ClO-)+c(HClO)+c(OH-) |
| A. | 食品保鲜膜、一次性食品袋的主要成分是聚乙烯 | |
| B. | 在家用燃煤中加入适量的生石灰能有效减少二氧化硫的排放量 | |
| C. | 若使用氯气处理水,能达到消毒杀菌和除去悬浮杂质的目的 | |
| D. | 一定浓度的双氧水可用于伤口的消毒 |
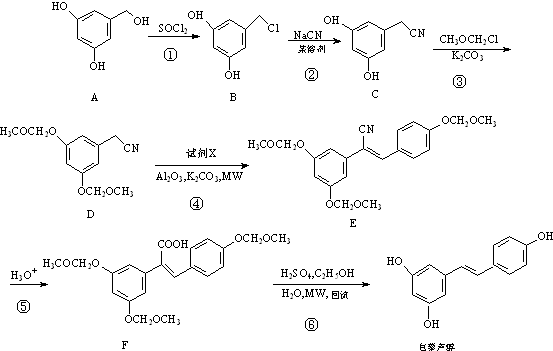
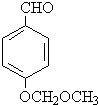 .
.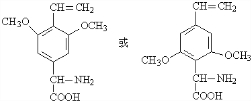 (任写一种).
(任写一种). .
.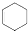 的六元环结构,六元环上只有一个取代基
的六元环结构,六元环上只有一个取代基