题目内容
【题目】研究电解质在水溶液中的平衡能了解它的存在形式。
(1)已知部分弱酸的电离常数如下表:
化学式 | HF | H2CO3 | H2S |
电离平衡常数K(25℃) |
|
|
|
①写出H2S的Ka1的表达式:________________。
②常温下,pH相同的三种溶液NaF、Na2CO3、Na2S,物质的量浓度最小的是_______。
③将过量H2S通入Na2CO3溶液,反应的离子方程式是_______________。
(2)室温下,用0.100 mol·L-1 盐酸溶液滴定20.00 mL 0.100 mol·L-1 的氨水溶液,滴定曲线如图所示。(忽略溶液体积的变化,①②填“>”“<”或“=”)
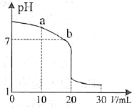
①a点所示的溶液中c(NH3·H2O)___________c(Cl-)。
②b点所示的溶液中c(Cl-)___________c(NH4+)。
③室温下pH=11的氨水与pH=5的NH4Cl溶液中,由水电离出的c(H+)之比为__________。
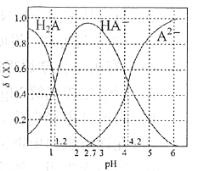
(3)二元弱酸H2A溶液中H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示。则H2A第二级电离平衡常数Ka2=___________。
【答案】c(H+)·c(HS-)/c(H2S) Na2S H2S+CO32-=HCO3-+HS < = 1:106 10-4.2
【解析】
Ka为弱酸的电离平衡常数,Ka值越大,在相同条件下,酸性越强,即酸性有HF>H2CO3>H2S>HCO3->HS-,多元弱酸电离分步,以第一步为主,同理,多元弱酸盐水解也分步,以第一步为主,据此解答。
(1)①平衡常数为生成物浓度的幂之积与反应物浓度幂之积的比值,根据H2SO3![]() HSO3- +H+可知Ka的表达式为c(H+)·c(HS-)/c(H2S);
HSO3- +H+可知Ka的表达式为c(H+)·c(HS-)/c(H2S);
②相同浓度的NaF、Na2CO3、Na2S中,由于酸性HF>HCO3->HS-,根据越弱越水解,S2-水解程度最大,产生的OH-浓度最大,pH值最大;故pH相同的三种溶液NaF、Na2CO3、Na2S,浓度最小的为Na2S,答案为:Na2S;
③将过量H2S通入Na2CO3溶液,根据强酸制弱酸的原理,由于酸性H2CO3>H2S>HCO3->HS-,所以,即便H2S过量,也只能生成HCO3-和HS-,而不能生成CO2,答案为:H2S+ CO32-=HCO3-+HS-;
(1)①用0.100 mol·L-1 盐酸溶液滴定20.00 mL 0.100 mol·L-1 的氨水溶液时,在a点消耗盐酸10.00 mL时,反应后生成的氯化铵和剩余的NH3·H2O的物质的量相等,若只考虑氯化铵电离,c(NH4+)和c(Cl-)相等,但NH4+要水解消耗,a点pH大于7,呈碱性,以电离为主,产生的NH4+多,所以c(Cl-)<c(NH4+);
②b点溶液中存在电荷守恒,c(NH4+)+ c(H+) =c(Cl-) +c(OH-),b点pH值为7,c(H+) = c(OH-),故c(NH4+) =c(Cl-),答案为:=;
③pH=11的氨水,氨水不能电离出H+,溶液中H+就是水电离出的H+,c(H+)为1×10-11, pH=5的NH4Cl溶液中铵根水解,溶液显酸性,溶液中水电离出的c(H+)为1×10-5,故由水电离出的c(H+)之比为1:106;
(3)H2A的二级电离为HA-![]() H++A2-,Ka2=c(H+)×c(A2-)/c(HA-),电离平衡常数是温度的常数,从图中取c(A2-)=c(HA-)特殊点,Ka2= c(H+)=10-4.2,故答案为:10-4.2。
H++A2-,Ka2=c(H+)×c(A2-)/c(HA-),电离平衡常数是温度的常数,从图中取c(A2-)=c(HA-)特殊点,Ka2= c(H+)=10-4.2,故答案为:10-4.2。