��Ŀ����
����Ŀ����ѧ��ȤС���ijƷ��������Ħ�����ɷּ��京����������̽����
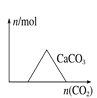
������ϣ�������Ħ������̼��ơ�����������ɣ������������ɷ���������ʱ���������ɡ�
I��Ħ���������������Ķ��Լ���ȡ����������Ʒ����ˮ��ֽ��衢���ˡ�
(1)�������м������NaOH��Һ�����ˡ�����������NaOH��Һ��Ӧ�����ӷ���ʽ��________��
(2)��(1)������Һ����ͨ�����������̼���ټ������ϡ���ᡣ�۲쵽��������_______��
II��������Ʒ��̼��ƵĶ����ⶨ
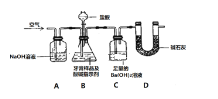
������ͼ��ʾװ��(ͼ�мг�������ȥ)����ʵ�飬��ַ�Ӧ�ⶨC�����ɵ�BaCO3������������ȷ��̼��Ƶ�����������
����ʵ����̻ش��������⣺
(3)Dװ�õ�������__________��
(4)���и����ʩ�У�������߲ⶨȷ�ȵ���__________(����)��
���ڼ�������֮ǰ��Ӧ�ž�װ���ڵ�CO2����
�ڵμ�����˹���
����A-B֮������ʢ��ŨH2SO4��ϴ��װ��
����B-C֮������ʢ�б���NaHCO3��Һ��ϴ��װ��
(5)ʵ����ȷ��ȡ10.00g��Ʒ���ݣ��������βⶨ�����BaCO3ƽ������Ϊ3.94g������Ʒ��̼��Ƶ���������Ϊ__________��
���𰸡�Al(OH)3+OH-=AlO2-+2H2O ͨ��CO2�����а�ɫ�������ɣ��ټ�������ʱ�����ܽ⣬ͬʱ��������� ��ֹ�����еĶ�����̼������������Ӧ��Ӱ��ⶨ��� �ۢ� 20.00%
��������
I.(1)����������NaOH��Һ��Ӧ����ƫ��������ˮ��
(2)��(1)������Һ����ͨ�����������̼��������ӦAlO2-+CO2+2H2O=Al(OH)3��+HCO3-���ټ������ϡ���ᣬAl(OH)3+3HCl=AlCl3+3H2O��HCO3-+H+=CO2��+H2O���������ʵ��ܽ��Է����ж�ʵ������
II.(3)��ֹ�����ж�����̼������������Ӧ����̼�ᱵ��ˮ��
(4)���ڼ�������֮ǰ��Ӧ�ž�װ���ڵ�CO2���壬��ֹ�����ж�����̼����C�������������գ�
�ڵμ�������죬�����ɶ�����̼���죬C�ж�����̼����ȫ�������գ�
��BC�о�Ϊˮ��Һ������Ҫ���
�ܻӷ���HCl����ʢ�б���̼��������Һ��ϴ��װ�û����ɶ�����̼��
(5)��BaCO3�������������ʵ�����Ȼ�����CԪ���غ������Ʒ�к��е�CaCO3�����������Ʒ�к���CaCO3������������
I.(1)��������Al(OH)3��NaOH��Һ��Ӧ����NaAlO2��ˮ����Ӧ���ӷ���ʽΪAl(OH)3+OH-=AlO2-+2H2O��
(2)��(1)������Һ����ͨ�����������̼��������ӦAlO2-+CO2+2H2O=Al(OH)3��+HCO3-���ټ������ϡ���ᣬAl(OH)3+3HCl=AlCl3+3H2O��HCO3-+H+=CO2��+H2O����˹۲쵽��ʵ��������ͨ��CO2�����а�ɫ�������ɣ��ټ�������ʱ�����ܽ⣬ͬʱ�����������
II.(3)װ��D�к��м�ʯ�ң��ܹ�������е�CO2������Ӧ�����D�������Ƿ�ֹ�����еĶ�����̼������������Ӧ��Ӱ��ⶨ�����
(4)���ڼ�������֮ǰ��Ӧ�ž�װ���ڵ�CO2���壬��ֹ�����ж�����̼����C�������������գ�������ǰ�ž�װ���еĶ�����̼������߲ⶨȷ�ȣ��ٲ��������⣻
�ڵμ�������죬�����ɶ�����̼���죬C�ж�����̼����ȫ�������գ�����Ҫ�����μ����ᣬ������߲ⶨȷ�ȣ��ڲ��������⣻
��B��C�о�Ϊˮ��Һ������Ҫ���������A��B֮������ʢ��Ũ�����ϴ��װ�ã�������߲ⶨȷ�ȣ��۷������⣻
�ܻӷ���HCl����ʢ�б���̼��������Һ��ϴ��װ�û����ɶ�����̼������C�б������������յĶ�����̼ƫ�࣬������B��C֮������ʢ�б���̼��������Һ��ϴ��װ�ã���ʹ�ⶨȷ��ƫ�ͣ��ܷ������⣻
�ʺ���ѡ���Ǣۢܣ�
(5)BaCO3����Ϊ3.94g����n(BaCO3)=![]() =0.02mol�������CԪ���غ��֪��Ʒ��CaCO3�����ʵ���n(CaCO3)=0.02mol��������m(CaCO3)=0.02mol��100g/mol=2.0g��������Ʒ��̼��Ƶ���������Ϊ
=0.02mol�������CԪ���غ��֪��Ʒ��CaCO3�����ʵ���n(CaCO3)=0.02mol��������m(CaCO3)=0.02mol��100g/mol=2.0g��������Ʒ��̼��Ƶ���������Ϊ![]() ��100%=20.00%��
��100%=20.00%��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ���о��������ˮ��Һ�е�ƽ�����˽����Ĵ�����ʽ��
��1����֪��������ĵ��볣�����±���
��ѧʽ | HF | H2CO3 | H2S |
����ƽ�ⳣ��K(25��) |
|
|
|
��д��H2S��Ka1�ı���ʽ��________________��
�ڳ����£�pH��ͬ��������ҺNaF��Na2CO3��Na2S�����ʵ���Ũ����С����_______��
�۽�����H2Sͨ��Na2CO3��Һ����Ӧ�����ӷ���ʽ��_______________��
��2�������£���0.100 mol��L��1 ������Һ�ζ�20.00 mL 0.100 mol��L��1 �İ�ˮ��Һ���ζ�������ͼ��ʾ��(������Һ����ı仯���٢����������������)
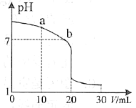
��a����ʾ����Һ��c(NH3��H2O)___________c(Cl��)��
��b����ʾ����Һ��c(Cl��)___________c(NH4��)��
��������pH��11�İ�ˮ��pH��5��NH4Cl��Һ�У���ˮ�������c(H��)֮��Ϊ__________��
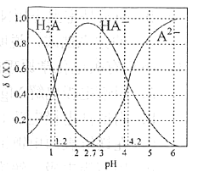
��3����Ԫ����H2A��Һ��H2A��HA����A2�������ʵ���������(X)��pH�ı仯��ͼ��ʾ����H2A�ڶ�������ƽ�ⳣ��Ka2��___________��