题目内容
【题目】现有甲、乙两个容积相同的密闭容器,分别充入NH3和N2,当它们的温度和密度都相同时,下列说法中正确的是( )
A.两容器气体的质量相等B.两容器气体所含分子数相等
C.两容器气体所含原子数相等D.两容器中气体的压强相等
【答案】A
【解析】
现有甲、乙两个容积相同的密闭容器,分别充入NH3和N2,当它们的温度和密度都相同时,其质量相等。
A.根据m=ρV知,体积相同、密度相同,故质量相等,选项A正确;
B.根据n=![]() 知,气体质量相等,二者摩尔质量不等,所以其物质的量不等,所含有分子数不相等,选项B错误;
知,气体质量相等,二者摩尔质量不等,所以其物质的量不等,所含有分子数不相等,选项B错误;
C.两者的物质的量之比为![]() ,所含原子数之比为
,所含原子数之比为![]() ,则其原子数不相等,选项C错误;
,则其原子数不相等,选项C错误;
D.体积和温度相等时,气体的压强与气体的物质的量成正比,因两者的物质的量不相等,故压强不相等,选项D错误;
答案选A。

【题目】研究电解质在水溶液中的平衡能了解它的存在形式。
(1)已知部分弱酸的电离常数如下表:
化学式 | HF | H2CO3 | H2S |
电离平衡常数K(25℃) |
|
|
|
①写出H2S的Ka1的表达式:________________。
②常温下,pH相同的三种溶液NaF、Na2CO3、Na2S,物质的量浓度最小的是_______。
③将过量H2S通入Na2CO3溶液,反应的离子方程式是_______________。
(2)室温下,用0.100 mol·L-1 盐酸溶液滴定20.00 mL 0.100 mol·L-1 的氨水溶液,滴定曲线如图所示。(忽略溶液体积的变化,①②填“>”“<”或“=”)
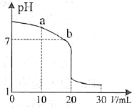
①a点所示的溶液中c(NH3·H2O)___________c(Cl-)。
②b点所示的溶液中c(Cl-)___________c(NH4+)。
③室温下pH=11的氨水与pH=5的NH4Cl溶液中,由水电离出的c(H+)之比为__________。
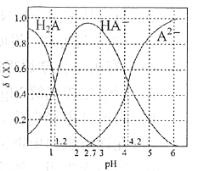
(3)二元弱酸H2A溶液中H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示。则H2A第二级电离平衡常数Ka2=___________。