题目内容
6.N2H4是一种高效清洁的火箭燃料.0.25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量.则下列热化学方程中正确的是( )| A. | $\frac{1}{2}$ N2H4(g)+$\frac{1}{2}$O2(g)=$\frac{1}{2}$N2(g)+H2O(l)△H=+267kJ•mol-1 | |
| B. | N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-133.5kJ•mol-1 | |
| C. | N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=+534kJ•mol-1 | |
| D. | N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ•mol-1 |
分析 根据热化学方程式的意义以及热化学方程式的书写方法可知,书写热化学方程式时应标注物质的聚集状态,放热反应的反应热为负值,化学计量数要和反应热成比例,据此解答.
解答 解:A、0.25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量,其焓变是负值,故A错误;
B、0.25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量,则1mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ×4=534kJ的热量,故B错误;
C、N2H4(g)完全燃烧生成氮气和气态水时,放出热量,其焓变是负值,故C错误;
D、0.25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量,则1mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ×4=534kJ的热量,热化学方程式为N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ•mol-1,故D正确.
故选D.
点评 本题考查学生热化学方程式的意义以及热化学方程式的书写方法,可以根据所学知识来回答,难度不大.

练习册系列答案
相关题目
16. 美国梅奥诊所的研究人员发现,绿茶中含有EGCG(表没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构式为:有关EGCG的说法错误的是( )
美国梅奥诊所的研究人员发现,绿茶中含有EGCG(表没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构式为:有关EGCG的说法错误的是( )
 美国梅奥诊所的研究人员发现,绿茶中含有EGCG(表没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构式为:有关EGCG的说法错误的是( )
美国梅奥诊所的研究人员发现,绿茶中含有EGCG(表没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构式为:有关EGCG的说法错误的是( )| A. | EGCG能与碳酸钠溶液反应放出二氧化碳 | |
| B. | EGCG遇FeCl3溶液能发生显色反应 | |
| C. | 1molEGCG最多可与含10mol NaOH的溶液完全作用 | |
| D. | EGCG在空气中易氧化 |
17.下列叙述正确的是( )
| A. | 乙烯的最简式C2H4 | B. | 乙醇的结构简式C2H6O | ||
| C. | 四氯化碳的电子式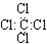 | D. | 甲苯能使酸性高锰酸钾溶液褪色 |
1.质量为mg的铜丝灼热变黑,立即插入下列物质中,能使铜丝变红,而且质量仍为mg的是( )
| A. | 稀HNO3 | B. | CO | C. | CH3CH2CH2OH | D. | 稀H2SO4 |
11.关于Li原子结构和性质的判断如下:①与H2O反应比Na剧烈;②它的原子半径比Na小;③它的氧化物暴露在空气中易吸收H2O和CO2;④它的阳离子最外层电子数和钠离子的最外层电子数相同;⑤它在反应中只能作还原剂;⑥Li应保存在煤油中,以隔绝空气;⑦Li在空气中燃烧生成Li2O2.其中错误的组合是( )
| A. | ①④⑥⑦ | B. | ①②③ | C. | ③⑤⑥ | D. | ①⑥⑦ |
18.在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是( )
| A. | 正极附近的S042-离子浓度逐渐增大 | |
| B. | 电子通过导线由铜片流向锌片 | |
| C. | 铜片上有H2逸出 | |
| D. | 溶液的pH逐渐变小 |
16.下列排列顺序正确的是( )
| A. | 粒子半径:Al3+>Mg2+>F- | B. | 热稳定性:HI>HBr>HCl>HF | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3>Mg(OH)2>NaOH |
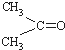 )与两个烃基相连的化合物叫酮(如丙酮 ).下列醇能发生脱氢氧化,但不可能得到醛类化合物的是( )
)与两个烃基相连的化合物叫酮(如丙酮 ).下列醇能发生脱氢氧化,但不可能得到醛类化合物的是( )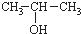
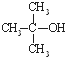
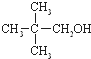
 回答下列问题:
回答下列问题: