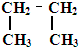题目内容
15. 回答下列问题:
回答下列问题:(1)“辛烷值”用来表示汽油的质量,汽油中异辛烷的爆震程度最小,将其辛烷值标定为100,如图是异辛烷的球棍模型,则异辛烷的系统命名为2,2,4-三甲基戊烷
(2)若某共价化合物分子中只含有C、N、O、H四种元素,且以n(C)、n(N)和n(O)分别表示C、N和O的原子数目,则H原子数目最多等于2n(C)+n(N)+2;
(3)某有机物A含有C、H、O三种元素,其蒸气密度是相同条件下H2密度的29倍,把1.16g该有机物在O2中充分燃烧,将生成物通过足量碱石灰,碱石灰增重3.72g,又知生成的CO2和H2O的物质的量之比为1:1.
①有机物A的分子式C3H6O;
②该有机物的红外光谱显示该分子是有一个羟基,无甲基的链状结构,请写出A的结构简式CH2=CHCH2OH.
分析 (1)先根据球棍模型写出该有机物的结构简式为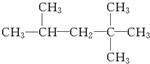 ,由烷烃的系统命名法可知其名称;
,由烷烃的系统命名法可知其名称;
(2)根据要使H原子最多,分子中就不能有双键,n(C)最多能结合2n(C)+2个H(烷烃),n(N)最多能结合n(N)+2个H原子(可以推导出:NH3、NH2-NH2、NH2-NH-NH2、…),碳链和氮链连在一起,各自还要去掉2个H,当O作为-OH存在时,H原子数目最多,且O的存在不影响H原子的个数来分析;
(3)有机物A的相对分子质量=29×2=58,1.16g有机物A的物质的量=1.16g÷58g/mol=0.02mol,设1.16g有机物A燃烧生成CO2的为xmol,则H2O的也为xmol,故44x+18x=3.72,计算出x根据质量守恒定律确定A的分子式;
②有机物分子式为C3H6O,该有机物分子有一个羟基,无甲基的链状结构,根据其不饱和度及分子式确定其结构简式.
解答 解:(1)解:根据异辛烷的球棍模型可知其结构简式图: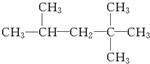 ,根据烷烃的命名原则,最长碳链有5个碳原子,取代基3个,都为甲基,距两端碳原子相等,支链编号之和最小,右边的端碳原子为1号碳原子,其系统命名为:2,2,4-三甲基戊烷,
,根据烷烃的命名原则,最长碳链有5个碳原子,取代基3个,都为甲基,距两端碳原子相等,支链编号之和最小,右边的端碳原子为1号碳原子,其系统命名为:2,2,4-三甲基戊烷,
故答案为:2,2,4-三甲基戊烷;
(2)要使H原子最多,分子中就不能有双键,n(C)最多能结合2n(C)+2个H(烷烃),n(N)最多能结合n(N)+2个H原子(可以推导出:NH3、NH2-NH2、NH2-NH-NH2、…),碳链和氮链连在一起,各自还要去掉1个H,当O作为-OH存在时,H原子数目最多,且O的存在不影响H原子的个数,所以形成一个分子中,最多有H原子:2n(C)+2+n(N)+2-2=2n(C)+n(N)+2,
故答案为:2n(C)+n(N)+2;
(3)①有机物A的相对分子质量为:29×2=58,1.16g有机物A的物质的量为:1.16g÷58g/mol=0.02mol,
设1.16g有机物A燃烧生成CO2的为xmol,则H2O的也为xmol,故44x+18x=3.72,解得:x=0.06,故有机物分子C原子数目为:$\frac{0.06mol}{0.02mol}$=3、H原子数目为:$\frac{0.06mol×2}{0.02mol}$=6、O原子数目为:$\frac{58-12×3-6}{16}$=1,则有机物分子式为C3H6O,
故答案为:C3H6O;
②该有机物的分子式为C3H6O,分子有一个羟基,无甲基的链状结构,故有机物A的结构简式为:CH2=CHCH2OH,
故答案为:CH2=CHCH2OH.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,注意掌握常见有机物结构与性质,明确有机物的命名方法,试题充分考查了学生的分析、理解能力及灵活应用基础知识的能力.

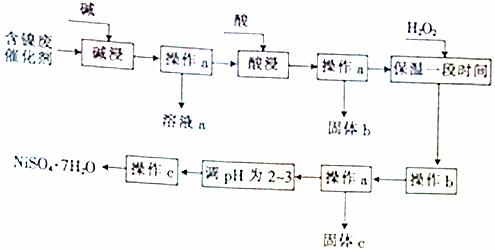
部分阳离子以氢氧化物形式沉淀时的pH如下:
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
(2)“碱浸”过程中发生反应的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O.
(3)“酸浸”时所加入的酸是H2SO4(填化学式).
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1.
(5)溶液a中加入盐酸可制得AlCl3溶液,AlCl3溶液可用于制备聚合氯化铝.聚合氯化铝是一种新型净水剂,其中铝主要以[AlO4Al12(OH)24(H2O)12]7+(用Alb表示)的形式存在.
①写出用溶液a与盐酸反应制备AlCl3的离子方程式:AlO2-+4H+=Al3++2H2O.
②一定条件下,向1.0mol•L-1的AlCl3溶液中加入0.6mol•L-1的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液.写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+.
| A. | $\frac{1}{2}$ N2H4(g)+$\frac{1}{2}$O2(g)=$\frac{1}{2}$N2(g)+H2O(l)△H=+267kJ•mol-1 | |
| B. | N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-133.5kJ•mol-1 | |
| C. | N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=+534kJ•mol-1 | |
| D. | N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ•mol-1 |
| A. | 2.5 mol | B. | 2 mol | C. | 1.25 mol | D. | 0.5 mol |
| A. | 化学反应速率是用于衡量化学反应进行快慢的物理量 | |
| B. | 决定化学反应速率的主要因素是反应物本身的性质 | |
| C. | 可逆反应达到化学平衡状态时,反应停止,正、逆反应速率都为零 | |
| D. | 增大反应物浓度或升高反应温度都能加快化学反应速率 |
| A. | CaBr2 | B. | Na2O2 | C. | HBr | D. | N2 |
| A. | 苯与浓硝酸、浓硫酸共热并保持50~60℃反应生成硝基苯 | |
| B. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 | |
| C. | 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 | |
| D. | 用乙醇和3%的硫酸共热到170℃制取乙烯 |
| A. | 乙烯与溴水(加成反应) | B. | 苯与液溴(取代反应) | ||
| C. | 乙醇与乙酸的酯化反应(取代反应) | D. | 乙醇与氧气(取代反应) |