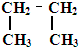题目内容
17.下列叙述正确的是( )| A. | 乙烯的最简式C2H4 | B. | 乙醇的结构简式C2H6O | ||
| C. | 四氯化碳的电子式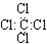 | D. | 甲苯能使酸性高锰酸钾溶液褪色 |
分析 A、最简式表示的是有机物中原子个数的最简整数比;
B、含有官能团的有机物,结构简式要突出官能团,不能省略;
C、四氯化碳和C与Cl均满足8个电子的稳定结构;
D、甲苯中甲基受苯环的影响,能被高锰酸钾溶液氧化.
解答 解:A、乙烯的分子式为C2H4,则乙烯的最简式为CH2,故A错误;
B、有机物的结构简式必须表示出官能团,则乙醇的结构简式为:C2H5OH,故B错误;
C、四氯化碳中Cl原子周围8个电子,则四氯化碳电子式为 ,故C错误;
,故C错误;
D、甲苯中甲基受苯环的影响,能被高锰酸钾溶液氧化,即甲苯能使酸性高锰酸钾溶液褪色,故D正确,故选D.
点评 本题主要考查了最简式、结构简式、电子式等的书写和甲苯的性质,侧重于基础知识的考查,题目难度不大,注意含有官能团的有机物在书写结构简式时官能团不能缩写.

练习册系列答案
相关题目
8.下列有机物分子中,所有原子一定在同一平面内的是( )
| A. | 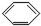 | B. | 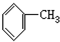 | C. | 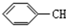 =CH2 =CH2 | D. | CH3CH=CH2 |
5.某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
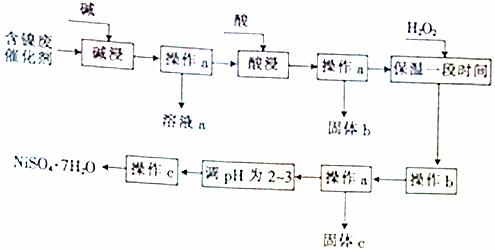
部分阳离子以氢氧化物形式沉淀时的pH如下:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外,还需要的主要仪器有漏斗、蒸发皿.
(2)“碱浸”过程中发生反应的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O.
(3)“酸浸”时所加入的酸是H2SO4(填化学式).
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1.
(5)溶液a中加入盐酸可制得AlCl3溶液,AlCl3溶液可用于制备聚合氯化铝.聚合氯化铝是一种新型净水剂,其中铝主要以[AlO4Al12(OH)24(H2O)12]7+(用Alb表示)的形式存在.
①写出用溶液a与盐酸反应制备AlCl3的离子方程式:AlO2-+4H+=Al3++2H2O.
②一定条件下,向1.0mol•L-1的AlCl3溶液中加入0.6mol•L-1的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液.写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+.

部分阳离子以氢氧化物形式沉淀时的pH如下:
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
(2)“碱浸”过程中发生反应的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O.
(3)“酸浸”时所加入的酸是H2SO4(填化学式).
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1.
(5)溶液a中加入盐酸可制得AlCl3溶液,AlCl3溶液可用于制备聚合氯化铝.聚合氯化铝是一种新型净水剂,其中铝主要以[AlO4Al12(OH)24(H2O)12]7+(用Alb表示)的形式存在.
①写出用溶液a与盐酸反应制备AlCl3的离子方程式:AlO2-+4H+=Al3++2H2O.
②一定条件下,向1.0mol•L-1的AlCl3溶液中加入0.6mol•L-1的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液.写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+.
2.下列各有机物的分类或命名正确的是( )
| A. | 对甲基苯酚属于芳香烃 | B. | 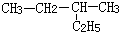 2-乙基丁烷 2-乙基丁烷 | ||
| C. | 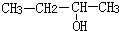 3-丁醇 3-丁醇 | D. | 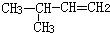 3-甲基-1-丁烯 3-甲基-1-丁烯 |
6.N2H4是一种高效清洁的火箭燃料.0.25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量.则下列热化学方程中正确的是( )
| A. | $\frac{1}{2}$ N2H4(g)+$\frac{1}{2}$O2(g)=$\frac{1}{2}$N2(g)+H2O(l)△H=+267kJ•mol-1 | |
| B. | N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-133.5kJ•mol-1 | |
| C. | N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=+534kJ•mol-1 | |
| D. | N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ•mol-1 |
 .该物质遇水剧烈反应,产生有刺激性气味的混合气体X和Y,同时还有固体单质产生,X是一种能使品红溶液褪色的气体,Y在标准状态下的密度为1.63g/L,该混合气体相对于H2的密度为21,写出上述过程对应的化学方程式2S2Cl2+2H2O=SO2↑+4HCl↑+3S↓.某研究性小组同学开动脑筋,为确定干燥的X 和Y混合气体中Y的存在,设计方案如下:把干燥的X和Y与干燥的NH3混合,出现白烟,则证明有Y气体.你认为此方案正确 (填正确,不正确),理由是SO2与干燥的NH3不反应,而HCl和干燥的NH3反应生成白烟.
.该物质遇水剧烈反应,产生有刺激性气味的混合气体X和Y,同时还有固体单质产生,X是一种能使品红溶液褪色的气体,Y在标准状态下的密度为1.63g/L,该混合气体相对于H2的密度为21,写出上述过程对应的化学方程式2S2Cl2+2H2O=SO2↑+4HCl↑+3S↓.某研究性小组同学开动脑筋,为确定干燥的X 和Y混合气体中Y的存在,设计方案如下:把干燥的X和Y与干燥的NH3混合,出现白烟,则证明有Y气体.你认为此方案正确 (填正确,不正确),理由是SO2与干燥的NH3不反应,而HCl和干燥的NH3反应生成白烟.