题目内容
11.关于Li原子结构和性质的判断如下:①与H2O反应比Na剧烈;②它的原子半径比Na小;③它的氧化物暴露在空气中易吸收H2O和CO2;④它的阳离子最外层电子数和钠离子的最外层电子数相同;⑤它在反应中只能作还原剂;⑥Li应保存在煤油中,以隔绝空气;⑦Li在空气中燃烧生成Li2O2.其中错误的组合是( )| A. | ①④⑥⑦ | B. | ①②③ | C. | ③⑤⑥ | D. | ①⑥⑦ |
分析 ①同主族自上而下金属性增强,金属性越强,单质与水反应越剧烈;
②同主族自上而下,原子半径增大;
③氧化锂是碱性氧化物,与氧化钠性质相似;
④锂离子最外层有2个电子,钠离子最外层有8个电子;
⑤锂原子最外层有1个电子,容易失去电子;
⑥Li密度比煤油小;
⑦Li在空气中燃烧生成Li2O.
解答 解:①碱金属元素中随着原子序数的递增,金属性逐渐增强,失电子能力逐渐增强,所以Li与水反应不如钠剧烈,故错误;
②碱金属元素中随着原子序数的递增,原子半径逐渐增大,所以锂原子半径小于钠,故正确;
③氧化锂是碱性氧化物,所以它的氧化物在空气中易吸收二氧化碳,故正确;
④锂原子失去最外层电子后次外层变成最外层,锂离子最外层有2个电子,钠离子最外层有8个电子,所以它的阳离子最外层电子数与钠的阳离子不同,故错误;
⑤锂原子最外层有1个电子,容易失去电子,所以它是还原剂,故正确.
⑥Li密度比煤油小,应用液体石蜡保存,故错误;
⑦Li不如Na活泼,在空气中燃烧生成Li2O,故错误,
故选A.
点评 本题涉及元素周期律知识的考查,同主族元素的性质具有相似性和递变性,注意知识的迁移应用,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列分子中,VSEPR模型名称和分子立体构型名称相同,且分子中各原子最外层都满足8电子稳定结构的是( )
| A. | CH4 | B. | PCl3 | C. | SiCl4 | D. | XeF4 |
2.下列各有机物的分类或命名正确的是( )
| A. | 对甲基苯酚属于芳香烃 | B. | 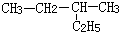 2-乙基丁烷 2-乙基丁烷 | ||
| C. | 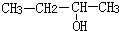 3-丁醇 3-丁醇 | D. | 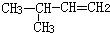 3-甲基-1-丁烯 3-甲基-1-丁烯 |
19.下列各物质属于芳香烃的是( )
| A. | 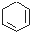 | B. |  | C. | 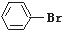 | D. | 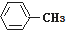 |
6.N2H4是一种高效清洁的火箭燃料.0.25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量.则下列热化学方程中正确的是( )
| A. | $\frac{1}{2}$ N2H4(g)+$\frac{1}{2}$O2(g)=$\frac{1}{2}$N2(g)+H2O(l)△H=+267kJ•mol-1 | |
| B. | N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-133.5kJ•mol-1 | |
| C. | N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=+534kJ•mol-1 | |
| D. | N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ•mol-1 |
3.若要使0.5mol甲烷完全和氯气发生取代反应,并生成相同物质的量的四种取代物,则需要氯气的物质的量为( )
| A. | 2.5 mol | B. | 2 mol | C. | 1.25 mol | D. | 0.5 mol |
20.下列化合物中既有离子键又有共价键的是( )
| A. | CaBr2 | B. | Na2O2 | C. | HBr | D. | N2 |
1.下列关于能量转化的认识中错误的是( )
| A. | 电解水生成氢气和氧气时,电能转化为化学能 | |
| B. | 绿色植物进行光合作用时,太阳能转化为化学能 | |
| C. | 电池充电是将电能转化为化学能 | |
| D. | 燃料电池的能量转化率可达100% |