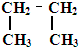题目内容
16.下列排列顺序正确的是( )| A. | 粒子半径:Al3+>Mg2+>F- | B. | 热稳定性:HI>HBr>HCl>HF | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3>Mg(OH)2>NaOH |
分析 A、电子层结构相同核电荷数越大,离子半径越小,电子层越多离子半径越大;
B、元素的非金属性越强,其气态氢化物越稳定;
C、元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
D、金属性越强,对应最高价氧化物的水化物的碱性越强.
解答 解:A、Mg2+、Al3+、F-离子核外电子排布相同,核电核数F<Mg<Al,则半径F->Mg2+>Al3+,故A错误;
B、已知非金属性:F>Cl>Br>I,元素的非金属性越强,对应氢化物越稳定,则氢化物的稳定性:HF>HCl>HBr>HI,故B错误;
C、非金属性Si<P<S<Cl,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,所以酸性为H2SiO3<H3PO4<H2SO4<HClO4,故C正确;
D、金属性Na>Mg>Al,对应最高价氧化物的水化物的碱性为:NaOH>Mg(OH)2>Al(OH)3,故D错误;
故选C.
点评 本题考查金属性和非金属性,明确物质的酸性、气态氢化物的稳定性,碱性与非金属性、金属性的关系是解答本题的关键,难度不大.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
6.N2H4是一种高效清洁的火箭燃料.0.25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量.则下列热化学方程中正确的是( )
| A. | $\frac{1}{2}$ N2H4(g)+$\frac{1}{2}$O2(g)=$\frac{1}{2}$N2(g)+H2O(l)△H=+267kJ•mol-1 | |
| B. | N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-133.5kJ•mol-1 | |
| C. | N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=+534kJ•mol-1 | |
| D. | N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ•mol-1 |
4.下列叙述中错误的是( )
| A. | 苯与浓硝酸、浓硫酸共热并保持50~60℃反应生成硝基苯 | |
| B. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 | |
| C. | 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 | |
| D. | 用乙醇和3%的硫酸共热到170℃制取乙烯 |
1.下列关于能量转化的认识中错误的是( )
| A. | 电解水生成氢气和氧气时,电能转化为化学能 | |
| B. | 绿色植物进行光合作用时,太阳能转化为化学能 | |
| C. | 电池充电是将电能转化为化学能 | |
| D. | 燃料电池的能量转化率可达100% |
5.下列各组物质间的反应与反应类型不相符的是( )
| A. | 乙烯与溴水(加成反应) | B. | 苯与液溴(取代反应) | ||
| C. | 乙醇与乙酸的酯化反应(取代反应) | D. | 乙醇与氧气(取代反应) |