��Ŀ����
16��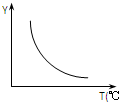 ��һ��������ܱ������У��������»�ѧ��Ӧ��CO2��g��+H2��g��?CO��g��+H2O��g�����仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
��һ��������ܱ������У��������»�ѧ��Ӧ��CO2��g��+H2��g��?CO��g��+H2O��g�����仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���| T�� | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
��1���÷�Ӧ����Ϊ��H��0�����÷�Ӧ������ͼ��ʾ�Ĺ�ϵ������ͼ�У�Y����ָCO2��H2�İٷֺ�����
��2�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������bc����ѡ�۷֣���
a��������ѹǿ���� b�����������c��CO������
c��v ��H2����=v ��H2O���� d��c��CO2��=c��CO��
��3��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��0.9•c��CO2��•c��H2���Tc��CO��•c��H2O�����ɴ˿����жϴ�ʱ���¶�Ϊ800�森�����������䣬�����¶ȣ�ԭ��ѧƽ��������Ӧ�����ƶ�����������桱���������ڻ��������ܶȲ��䣨���������С�����䡱��������ƽ����Է����������䣨���������С�����䡱����
��4������һ�ܱ������У���һ������CO��H2O��ϼ��ȵ�830���´ﵽƽ�⣮����Ӧ��ʼʱCO��H2O��Ũ�ȷֱ�Ϊ0.200mol/L��0.100mol/L��ƽ��ʱCO��ת����33.3%��
���� ��1���ɱ������ݿ�֪���¶�Խ��ƽ�ⳣ��Խ��˵�������¶�ƽ��������Ӧ�ƶ����ݴ��жϡ�H��
��ͼ��֪���¶�����Y�ı�ʾ�����������ͣ������¶�ƽ��������Ӧ�ƶ����ݴ�ѡ����ʵ���������
��2������Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�ȡ��ٷֺ������䣬�Լ��ɴ�������һЩ��Ҳ�������仯���ݴ˽�𣬽���ʱҪע�⣬ѡ���жϵ������������ŷ�Ӧ�Ľ��з����仯�������������ɱ仯����ֵʱ��˵�����淴Ӧ����ƽ��״̬��
��3��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��0.9•c��CO2��•c��H2��=c��CO��•c��H2O�����ݴ˼���ƽ�ⳣ���������ж��¶ȣ�
�����¶�ƽ��������Ӧ�ƶ��������������������䣬���������ܵ����ʵ������䣬ƽ����Է����������䣻
��4����������ʽ�����ƽ��ʱ����ֵ����ʵ������Ӷ�����ƽ��ʱCO��ת���ʣ�
��� �⣺��1���ɱ������ݿ�֪���¶�Խ��ƽ�ⳣ��Խ��˵�������¶�ƽ��������Ӧ�ƶ��������¶�ƽ�������ȷ�Ӧ�ƶ����ʡ�H��0��
��ͼ��֪���¶�����Y�ı�ʾ�����������ͣ������¶�ƽ��������Ӧ�ƶ�����Y����CO2��H2�İٷֺ����ȣ�
�ʴ�Ϊ������CO2��H2�İٷֺ�����
��2��a����Ӧǰ����������ʵ������䣬�¶�һ����������ѹǿʼ�ղ��䣬��ѹǿ���䣬����˵������ƽ��״̬����a����
b����Ӧ�ﵽƽ��״̬ʱ�������ʵ�Ũ�Ȳ��䣬���������c��CO������˵������ƽ��״̬����b��ȷ��
c��v ��H2����=v ��H2O������ͬ���ʱ�ʾ������֮�ȵ��ڻ�ѧ������֮�ȣ�˵������ƽ��״̬����c��ȷ��
d��ƽ��ʱ������̼��һ����̼��Ũ����ת�����йأ�c��CO2��=c��CO������˵������ƽ�⣬��d����
�ʴ�Ϊ��bc��
��3��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��0.9•c��CO2��•c��H2��=c��CO��•c��H2O������CO2��g��+H2��g��?CO��g��+H2O��g����ƽ�ⳣ��k=$\frac{c��CO��•c��{H}_{2}O��}{c��C{O}_{2}��•c��{H}_{2}��}$=0.9����Ϊ800�棬�÷�Ӧ����Ӧ�����ȷ�Ӧ�������¶�ƽ��������Ӧ�ƶ��������������������䣬������䣬�ܶȲ��䣬���������ܵ����ʵ������䣬ƽ����Է����������䣬
�ʴ�Ϊ��800���������䣬���䣻
��4��CO��g��+H2O��g��?CO2��g��+H2��g��
��ʼ��mol•L-1����0.200 0.100 0 0
�仯��mol•L-1����x x x x
ƽ�⣨mol•L-1����0.200-x 0.100-x x x
K=$\frac{c��C{O}_{2}��c��{H}_{2}��}{c��CO��c��{H}_{2}O��}$=$\frac{x��x}{��0.200-x������0.100-x��}$=1.0�����x=$\frac{2}{30}$��
��ƽ���CO��ת����Ϊ$\frac{\frac{2}{30}}{0.2}$=$\frac{1}{3}$=33.3%��
�ʴ�Ϊ��33.3%��
���� ���⿼�黯ѧƽ�ⳣ����Ӱ�����ء�ƽ���ƶ���ƽ��״̬���жϵȣ��Ѷ��еȣ�ע��ƽ��״̬���жϣ�ѡ��������������ŷ�Ӧ�Ľ��з����仯�������������ɱ仯����ֵʱ��˵�����淴Ӧ����ƽ��״̬��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�| A�� | ���ȷ�Ӧ | B�� | ���ȷ�Ӧ | C�� | ������ԭ��Ӧ | D�� | ��������ԭ��Ӧ |
| A�� | �٢ڢۢݢ� | B�� | �ݢڢ٢ۢ� | C�� | �ޢۢ٢ڢ� | D�� | �٢ڢݢۢ� |
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V��O2��/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.1 |
| A�� | 0��6 min��ƽ����Ӧ���ʣ�v��H2O2����0.33 mol/��L•min�� | |
| B�� | 6��10 min��ƽ����Ӧ���ʣ�v��H2O2����3.3��10-2 mol/��L•min�� | |
| C�� | ��Ӧ��6 minʱ��H2O2�ֽ���60% | |
| D�� | ��Ӧ��10 minʱ��c��H2O2����0.24 mol/L |
| A�� | 11.2 L�����������е�ԭ����ΪNA | |
| B�� | 7.8g��Na2O2�к��е������ӵ���ĿΪ0.2NA | |
| C�� | 0.10mol Fe ��������ˮ������Ӧ���ɵ�H2������Ϊ0.10NA | |
| D�� | 54g Al�ֱ���������ϡ���ἰ����������Һ��Ӧʧȥ�ĵ���������6NA |
���κ�������ˮ�ж���һ�����ܽ��
����Һ�ù��˵ķ�������
�۷�ɢϵһ���ǻ����
�ܶ����ЧӦ�������˶����������ǽ������������
��ͬһ�����ʵı�����ҺҪ�Ȳ�������ҺŨЩ
�����˶����ǽ��������е��˶���ʽ
���κ��ܽ���������Ե���ʺ���ʹ���������۳�
����ͬ�����£���ͬ���ʵ���Һ��������ҺҪ�Ȳ�������ҺŨЩ��
| A�� | �ۢޢ� | B�� | �ڢܢޢ�� | C�� | �٢ڢۢܢ� | D�� | ȫ������ȷ |
| A�� | 0.7g | B�� | 1.1 g | ||
| C�� | 2.2 g | D�� | ��1.1g��2.2g֮�� |
| A�� | ClO -ˮ��ƽ�ⳣ������ʽΪKh=$\frac{c��HClO��•c��O{H}^{-}��}{c��Cl{O}^{-}��}$ | |
| B�� | NH3•H2O�ĵ���ƽ�ⳣ������ʽΪKb=$\frac{c��N{H}_{4}^{+}��•c��O{H}^{-}��}{c��N{H}_{3}•{H}_{2}O��}$ | |
| C�� | PbI2�ܶȻ���������ʽΪKsp=c��Pb2+��•c2��I-�� | |
| D�� | SO2��g��+$\frac{1}{2}$O2��g��?SO3��g���Ļ�ѧƽ�ⳣ������ʽΪK=$\frac{{c}^{2}��S{O}_{3}��}{{c}^{2}��S{O}_{2}��•c��{O}_{2}��}$ |
| A�� | ��ϩ����Ȳ | B�� | ��ϩ����ϩ | C�� | �������� | D�� | �����ױ� |