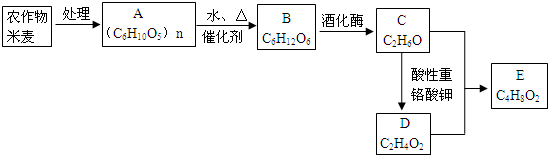
题目内容
1.下列判断正确的是( )①任何物质在水中都有一定的溶解度
②浊液用过滤的方法分离
③分散系一定是混合物
④丁达尔效应、布朗运动、渗析都是胶体的物理性质
⑤同一种溶质的饱和溶液要比不饱和溶液浓些
⑥布朗运动不是胶体所特有的运动方式
⑦任何溶胶加入可溶性电解质后都能使胶粒发生聚沉
⑧相同条件下,相同溶质的溶液,饱和溶液要比不饱和溶液浓些.
| A. | ③⑥⑧ | B. | ②④⑥⑧⑦ | C. | ①②③④⑤ | D. | 全部不正确 |
分析 ①有些物质与水互溶,没有溶解度,如乙醇、硝酸等;
②浊液分为悬浊液和乳浊液,乳浊液无法通过过滤分离;
③分散系是由分散质和分散剂组成的;
④渗析属于操作方法,不属于物理性质;
⑤温度影响溶解度,必须在相同温度下才能比较;
⑥布朗运动是悬浮在流体中的微粒受到流体分子与粒子的碰撞而发生的不停息的随机运动;
⑦只有带电荷的胶粒加入电解质后发生聚沉现象;
⑧相同条件下,相同溶质的饱和溶液一定比不饱和溶液浓.
解答 解:①酒精、H2SO4、HNO3能与水以任意比互溶,没有溶解度,故①错误;
②对乳浊液应通过分液的方法进行分离,无法通过过滤分离,故②错误;
③分散系是有分散质和分散剂组成的,属于混合物,故③正确;
④渗析是一种分离方法,不属于胶体的物理性质,不能透过半透膜是胶体的物理性质,故④错误;
⑤饱和溶液与不饱和溶液忽略了“一定温度”这一前提条件没有可比性,故⑤错误;
⑥布朗运动是悬浮在流体中的微粒受到流体分子与粒子的碰撞而发生的不停息的随机运动,不是胶体特有的性质,故⑥正确;
⑦对不带电胶粒,如淀粉胶体,加入可溶性电解质后不聚沉,故⑦正确;
⑧只有在相同条件下,相同溶质的溶液,饱和的要比不饱和的要浓,故⑧正确;
故选A.
点评 本题考查了溶解度、胶体的性质、饱和溶液和不饱和溶液等知识,题目难度中等,试题知识点较多,充分考查学生的分析能力及灵活应用基础知识的能力,注意掌握分散系的概念、分类,明确胶体的性质及影响溶解度大小的因素.

练习册系列答案
相关题目
11.设阿伏加德罗常数为NA,下列说法正确的是( )
| A. | 常温常压下,2g氦气所含原子数是0.5NA | |
| B. | 常温常压下,11.2L氯气所含分子数是0.5NA | |
| C. | 同温同压下,密度相同的两种气体的摩尔质量相同 | |
| D. | 同温同压下,原子数都是NA的两种气体的体积相同 |
9.铝硅合金具有熔点低、凝固时收缩率小等优点,适合铸造.现取试样10.0mg,放在纯净氧气中完全燃烧,燃烧后的固体经称量发现比原来试样增重9.23mg,由此计算硅铝合金中硅的质量分数为( )
| A. | 12.3% | B. | 15.4% | C. | 13.4% | D. | 17.0% |
16. 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表:
回答下列问题:
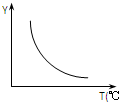
(1)该反应正向为△H>0;若该反应符合下图所示的关系,则在图中,Y轴是指CO2或H2的百分含量.
(2)能判断该反应达到化学平衡状态的依据是bc(多选扣分).
a.容器中压强不变 b.混合气体中c(CO)不变
c.v (H2)正=v (H2O)逆 d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:0.9•c(CO2)•c(H2)═c(CO)•c(H2O),由此可以判断此时的温度为800℃.其它条件不变,升高温度,原化学平衡向正反应方向移动(填“正”或“逆”),容器内混合气体的密度不变(填“增大”、“减小”或“不变”),气体平均相对分子质量不变(填“增大”、“减小”或“不变”).
(4)若在一密闭容器中,将一定量的CO与H2O混合加热到830℃下达到平衡.若反应开始时CO与H2O的浓度分别为0.200mol/L和0.100mol/L,平衡时CO的转化率33.3%.
 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表:| T℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应正向为△H>0;若该反应符合下图所示的关系,则在图中,Y轴是指CO2或H2的百分含量.
(2)能判断该反应达到化学平衡状态的依据是bc(多选扣分).
a.容器中压强不变 b.混合气体中c(CO)不变
c.v (H2)正=v (H2O)逆 d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:0.9•c(CO2)•c(H2)═c(CO)•c(H2O),由此可以判断此时的温度为800℃.其它条件不变,升高温度,原化学平衡向正反应方向移动(填“正”或“逆”),容器内混合气体的密度不变(填“增大”、“减小”或“不变”),气体平均相对分子质量不变(填“增大”、“减小”或“不变”).
(4)若在一密闭容器中,将一定量的CO与H2O混合加热到830℃下达到平衡.若反应开始时CO与H2O的浓度分别为0.200mol/L和0.100mol/L,平衡时CO的转化率33.3%.
6.下列溶液中通入SO2无明显现象的是( )
| A. | Ba(OH)2 | B. | Ba(NO3)2 | C. | 溴水 | D. | BaCl2 |
 亚硝酸(HN02)在工业上用于有机合成,既具有氧化性又具有还原性,而且氧化性比还原性突出得多.回答下列问题:
亚硝酸(HN02)在工业上用于有机合成,既具有氧化性又具有还原性,而且氧化性比还原性突出得多.回答下列问题: