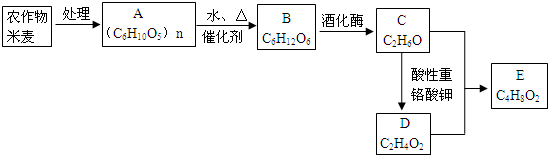
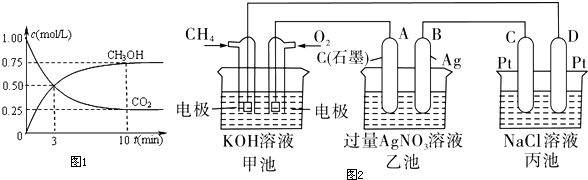
题目内容
5.下列常数表达式不正确的是( )| A. | ClO -水解平衡常数表达式为Kh=$\frac{c(HClO)•c(O{H}^{-})}{c(Cl{O}^{-})}$ | |
| B. | NH3•H2O的电离平衡常数表达式为Kb=$\frac{c(N{H}_{4}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$ | |
| C. | PbI2溶度积常数表达式为Ksp=c(Pb2+)•c2(I-) | |
| D. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)的化学平衡常数表达式为K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$ |
分析 A、次氯酸根离子结合水电离出的氢离子促进水的电离,溶液中氢氧根离子浓度增大,水解平衡常数等于生成物平衡浓度除以水解离子浓度;
B、一水合氨是弱电解质存在电离平衡,依据电离方程式书写电离平衡常数;
C、依据溶解沉淀平衡书写平衡常数;
D、化学平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
解答 解:A、次氯酸根离子结合水电离出的氢离子促进水的电离,溶液中氢氧根离子浓度增大,ClO-+H2O?HClO+OH-,水解平衡常数等于生成物平衡浓度除以水解离子浓度,为Kh=$\frac{c(HClO)•c(O{H}^{-})}{c(Cl{O}^{-})}$,故A正确;
B、一水合氨是弱电解质存在电离平衡,NH3•H2O?NH4++OH-,依据电离方程式书写电离平衡常数为Kb=$\frac{c(N{H}_{4}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$,故B正确;
C、沉淀溶解判断为PbI2(s)?Pb2+(aq)+2I-(aq)溶解沉淀平衡书写PbI2溶度积常数表达式为Ksp=c(Pb2+)•c2(I-),故C正确;
D、化学平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)的化学平衡常数表达式为K=$\frac{c(S{O}_{3})}{c(S{O}_{2}){c}^{\frac{1}{2}}({O}_{2})}$,故D错误;
故选D.
点评 本题考查了平衡常数的概念分析,和计算表达式的书写方法应用,掌握基础是解题关键,题目较简单.

练习册系列答案
相关题目
15.下列关于钠、钾的说法正确的是( )
①钠的熔点比钾的熔点高
②钠和钾在空气中燃烧的产物都是过氧化物
③钠和钾性质活泼且都是短周期元素
④钠和钾的合金常用作原子反应堆的导热剂
①钠的熔点比钾的熔点高
②钠和钾在空气中燃烧的产物都是过氧化物
③钠和钾性质活泼且都是短周期元素
④钠和钾的合金常用作原子反应堆的导热剂
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
16.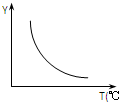 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表:
回答下列问题:
(1)该反应正向为△H>0;若该反应符合下图所示的关系,则在图中,Y轴是指CO2或H2的百分含量.
(2)能判断该反应达到化学平衡状态的依据是bc(多选扣分).
a.容器中压强不变 b.混合气体中c(CO)不变
c.v (H2)正=v (H2O)逆 d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:0.9•c(CO2)•c(H2)═c(CO)•c(H2O),由此可以判断此时的温度为800℃.其它条件不变,升高温度,原化学平衡向正反应方向移动(填“正”或“逆”),容器内混合气体的密度不变(填“增大”、“减小”或“不变”),气体平均相对分子质量不变(填“增大”、“减小”或“不变”).
(4)若在一密闭容器中,将一定量的CO与H2O混合加热到830℃下达到平衡.若反应开始时CO与H2O的浓度分别为0.200mol/L和0.100mol/L,平衡时CO的转化率33.3%.
 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表:| T℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应正向为△H>0;若该反应符合下图所示的关系,则在图中,Y轴是指CO2或H2的百分含量.
(2)能判断该反应达到化学平衡状态的依据是bc(多选扣分).
a.容器中压强不变 b.混合气体中c(CO)不变
c.v (H2)正=v (H2O)逆 d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:0.9•c(CO2)•c(H2)═c(CO)•c(H2O),由此可以判断此时的温度为800℃.其它条件不变,升高温度,原化学平衡向正反应方向移动(填“正”或“逆”),容器内混合气体的密度不变(填“增大”、“减小”或“不变”),气体平均相对分子质量不变(填“增大”、“减小”或“不变”).
(4)若在一密闭容器中,将一定量的CO与H2O混合加热到830℃下达到平衡.若反应开始时CO与H2O的浓度分别为0.200mol/L和0.100mol/L,平衡时CO的转化率33.3%.
20. 一定温度下,2L的密闭容器中,发生反应:A2(g)+3B2(g)?2AB3(g).A2在5min内物质的量由12mol变成了4mol.
一定温度下,2L的密闭容器中,发生反应:A2(g)+3B2(g)?2AB3(g).A2在5min内物质的量由12mol变成了4mol.
(1)该反应在这5min内的平均反应速率v(A2)=0.8 mol/(L•min).
(2)经过一段时间反应达到化学平衡状态,下列说法能充分说明该反应已达到化学平衡状态的是④.(填序号)
①A2、B2、AB3的浓度相等 ②正、逆反应速率均等于零
③A2、B2、AB3在容器中共存 ④A2、B2、AB3的浓度均不再改变
(3)下列条件不能改变该化学反应的限度的是④.(填序号)
①温度 ②浓度 ③压强 ④催化剂
(4)下列与改变化学反应速率无关的是③.(填序号)
①将食物存放在温度低的地方
②淀粉在淀粉酶的作用下发生水解反应
③铁粉与水蒸气的反应中,增加铁粉的用量
④将两种块状固体药品研细并混匀后再进行反应
(5)实验室可以利用稀硫酸与锌反应制取氢气.
①实验室用30%的稀硫酸溶液与锌粒反应制取氢气,反应进行一段时间后,气泡边得稀少了,锌粒还有剩余,再添加一些适当浓度的硫酸溶液到反应容器中,气泡又增多,其原因是浓度越大反应速率快.
②某学生为了探究锌与稀硫酸反应过程中速率变化.在100mL稀硫酸中加入足量的锌粉,标准状况下测得数据累计值如下:
在0~1、1~2、2~3、3~4、4~5min时间段中,反应速率最快的时间段是2~3min;0~5min内,化学反应速率变化的原因是H+浓度变小.
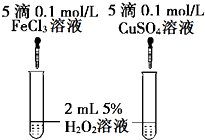
(6)经研究知Cu2+对H2O2分解具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学设计了如图甲、乙所示的实验.通过观察反应产生气泡的快慢,可定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是控制阴离子相同,排除阴离子的干扰.
 一定温度下,2L的密闭容器中,发生反应:A2(g)+3B2(g)?2AB3(g).A2在5min内物质的量由12mol变成了4mol.
一定温度下,2L的密闭容器中,发生反应:A2(g)+3B2(g)?2AB3(g).A2在5min内物质的量由12mol变成了4mol.(1)该反应在这5min内的平均反应速率v(A2)=0.8 mol/(L•min).
(2)经过一段时间反应达到化学平衡状态,下列说法能充分说明该反应已达到化学平衡状态的是④.(填序号)
①A2、B2、AB3的浓度相等 ②正、逆反应速率均等于零
③A2、B2、AB3在容器中共存 ④A2、B2、AB3的浓度均不再改变
(3)下列条件不能改变该化学反应的限度的是④.(填序号)
①温度 ②浓度 ③压强 ④催化剂
(4)下列与改变化学反应速率无关的是③.(填序号)
①将食物存放在温度低的地方
②淀粉在淀粉酶的作用下发生水解反应
③铁粉与水蒸气的反应中,增加铁粉的用量
④将两种块状固体药品研细并混匀后再进行反应
(5)实验室可以利用稀硫酸与锌反应制取氢气.
①实验室用30%的稀硫酸溶液与锌粒反应制取氢气,反应进行一段时间后,气泡边得稀少了,锌粒还有剩余,再添加一些适当浓度的硫酸溶液到反应容器中,气泡又增多,其原因是浓度越大反应速率快.
②某学生为了探究锌与稀硫酸反应过程中速率变化.在100mL稀硫酸中加入足量的锌粉,标准状况下测得数据累计值如下:
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(6)经研究知Cu2+对H2O2分解具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学设计了如图甲、乙所示的实验.通过观察反应产生气泡的快慢,可定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是控制阴离子相同,排除阴离子的干扰.
17.下列各化合物的命名中正确的是( )
| A. |  2,4-二硝基甲苯 2,4-二硝基甲苯 | B. | (CH3CH2)2CHCH33-甲基戊烷 | ||
| C. |  1,3-二甲基-2-丁烯 1,3-二甲基-2-丁烯 | D. |  异戊烷 异戊烷 |
14.下列各组物质熔点高低的比较正确的是( )
| A. | CF4>CCl4>CBr4>CI4 | B. | Na>Mg>Al | ||
| C. | SiO2>H2O>CO2 | D. | 晶体硅>SiC>金刚石 |