题目内容
6.下列各组物质中,能用酸性高锰酸钾溶液鉴别的是( )| A. | 乙烯、乙炔 | B. | 乙烯、丙烯 | C. | 苯、乙烷 | D. | 苯、甲苯 |
分析 能用高锰酸钾酸性溶液鉴别的有机物可能含有不饱和键、苯的同系物以及酚、醇、醛等具有还原性的物质,以此解答该题.
解答 解:A.乙烯和乙炔都含有不饱和键,都能与酸性高锰酸钾发生氧化还原反应,不能鉴别,故A错误;
B.乙烯和丙烯都含有不饱和键,都能与酸性高锰酸钾发生氧化还原反应,不能鉴别,故B错误;
C.苯、乙烷与酸性高锰酸钾都不反应,不能鉴别,故C错误;
D.甲苯能与酸性高锰酸钾发生氧化还原反应,使其褪色,苯与酸性高锰酸钾都不反应,现象不同,能鉴别,故D正确.
故选D.
点评 本题考查有机物的鉴别,题目难度不大,注意把握常见能与酸性高锰酸钾反应的有机物类型以及对应官能团的性质.

练习册系列答案
相关题目
16. 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表:
回答下列问题:
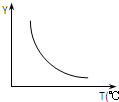
(1)该反应正向为△H>0;若该反应符合下图所示的关系,则在图中,Y轴是指CO2或H2的百分含量.
(2)能判断该反应达到化学平衡状态的依据是bc(多选扣分).
a.容器中压强不变 b.混合气体中c(CO)不变
c.v (H2)正=v (H2O)逆 d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:0.9•c(CO2)•c(H2)═c(CO)•c(H2O),由此可以判断此时的温度为800℃.其它条件不变,升高温度,原化学平衡向正反应方向移动(填“正”或“逆”),容器内混合气体的密度不变(填“增大”、“减小”或“不变”),气体平均相对分子质量不变(填“增大”、“减小”或“不变”).
(4)若在一密闭容器中,将一定量的CO与H2O混合加热到830℃下达到平衡.若反应开始时CO与H2O的浓度分别为0.200mol/L和0.100mol/L,平衡时CO的转化率33.3%.
 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表:| T℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应正向为△H>0;若该反应符合下图所示的关系,则在图中,Y轴是指CO2或H2的百分含量.
(2)能判断该反应达到化学平衡状态的依据是bc(多选扣分).
a.容器中压强不变 b.混合气体中c(CO)不变
c.v (H2)正=v (H2O)逆 d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:0.9•c(CO2)•c(H2)═c(CO)•c(H2O),由此可以判断此时的温度为800℃.其它条件不变,升高温度,原化学平衡向正反应方向移动(填“正”或“逆”),容器内混合气体的密度不变(填“增大”、“减小”或“不变”),气体平均相对分子质量不变(填“增大”、“减小”或“不变”).
(4)若在一密闭容器中,将一定量的CO与H2O混合加热到830℃下达到平衡.若反应开始时CO与H2O的浓度分别为0.200mol/L和0.100mol/L,平衡时CO的转化率33.3%.
17.下列各化合物的命名中正确的是( )
| A. | 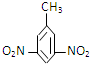 2,4-二硝基甲苯 2,4-二硝基甲苯 | B. | (CH3CH2)2CHCH33-甲基戊烷 | ||
| C. | 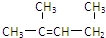 1,3-二甲基-2-丁烯 1,3-二甲基-2-丁烯 | D. | 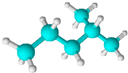 异戊烷 异戊烷 |
14.下列各组物质熔点高低的比较正确的是( )
| A. | CF4>CCl4>CBr4>CI4 | B. | Na>Mg>Al | ||
| C. | SiO2>H2O>CO2 | D. | 晶体硅>SiC>金刚石 |
18.在一密闭容器中充入一定量的H2和N2,经测定反应开始后3s内的v(H2)=0.3mol•L-1•s-1,则3s末NH3的浓度为( )
| A. | 0.45 mol•L-1 | B. | 0.6 mol•L-1 | C. | 0.9 mol•L-1 | D. | 1.2 mol•L-1 |
6.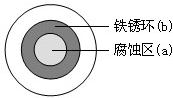 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( )
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( )
 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( )
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( )| A. | 液滴中的Cl-由a区向b区迁移 | |
| B. | 液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈 | |
| D. | 若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-═Cu2+ |
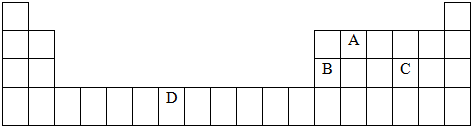
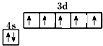 ,与D同周期的所有元素的基态原子中最外层电子数与D原子相同的元素有8种.
,与D同周期的所有元素的基态原子中最外层电子数与D原子相同的元素有8种.