题目内容
6.氢氧化钠与盐酸的反应属于( )| A. | 吸热反应 | B. | 放热反应 | C. | 氧化还原反应 | D. | 非氧化还原反应 |
分析 氢氧化钠与盐酸的反应属于中和反应,中和反应均是放热反应;此反应的化合价不变,属于非氧化还原反应.
解答 解:氢氧化钠与盐酸的反应属于中和反应,中和反应均是放热反应;氢氧化钠与盐酸的反应属于中和反应,化合价不变,属于非氧化还原反应.
故选BD.
点评 本题考查吸热反应和放热反应的例子,抓化学中常见的吸热或放热的反应是解题的关键,对于特殊过程中的热量变化的要熟练记忆来解答此类习题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.A、B、C、D、E是元素周期表前四周期中的五种常见元素,其相关信息如下表:
请回答下列问题
(1)C元素原子的价电子排布图是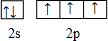
(2)E元素位于周期表ds区,E+离子的核外电子排布式是1s22s22p63s23p63d10
(3)CA3极易溶于水的主要原因是NH3与H2O分子间形成氢键C3-离子的中心原子采用sp杂化,C3-离子的空间构型是直线型
(4)A、C、E三种元素可形成〔E(CA3)4〕2+配离子,其中存在的化学键类型有①③(填序号,①配位键②金属键③极性共价键④非极性共价键⑤离子键⑥氢键)
(5)〔E(CA3)4〕2+可由E的硫酸盐溶液中通入过量CA3气体得到,写出该配离子的结构简式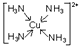 .
.
| 元素 | 相关信息 |
| A | A原子的1S轨道上只有1个电子 |
| B | B是电负性最大的元素 |
| C | C的基态原子2P轨道中有三个未成对电子 |
| D | D是主族元素且与E同周期,其最外层上有两个运动状态不同的电子 |
| E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
(1)C元素原子的价电子排布图是

(2)E元素位于周期表ds区,E+离子的核外电子排布式是1s22s22p63s23p63d10
(3)CA3极易溶于水的主要原因是NH3与H2O分子间形成氢键C3-离子的中心原子采用sp杂化,C3-离子的空间构型是直线型
(4)A、C、E三种元素可形成〔E(CA3)4〕2+配离子,其中存在的化学键类型有①③(填序号,①配位键②金属键③极性共价键④非极性共价键⑤离子键⑥氢键)
(5)〔E(CA3)4〕2+可由E的硫酸盐溶液中通入过量CA3气体得到,写出该配离子的结构简式
 .
.
14.下列离子方程式属于盐的水解,且书写正确的是( )
| A. | NaHCO3溶液:HCO3-+H2O?CO32-+H3O+ | |
| B. | NaHS溶液:HS-+H2O?H2S+OH- | |
| C. | Na2CO3溶液:CO32-+2H2O?H2CO3+2OH- | |
| D. | Cl2溶于H2O中:Cl2+H2O═H++Cl-+HClO |
11.设阿伏加德罗常数为NA,下列说法正确的是( )
| A. | 常温常压下,2g氦气所含原子数是0.5NA | |
| B. | 常温常压下,11.2L氯气所含分子数是0.5NA | |
| C. | 同温同压下,密度相同的两种气体的摩尔质量相同 | |
| D. | 同温同压下,原子数都是NA的两种气体的体积相同 |
18.根据下列事实所作的结论,正确的是( )
| 编号 | 事实 | 结论 |
| A | 甲、乙两种有机物具有相同相对分子质量和不同结构 | 甲和乙一定是同分异构体 |
| B | 质量相同的甲、乙两种有机物完全燃烧时产生质量相同的水 | 甲、乙两种分子中,H原子个数一定相同 |
| C | 不存在两种二氯甲烷 | CCl2F2一定只有一种 |
| D | 一种烃在足量的氧气中燃烧并通过浓硫酸后气体体积减少 | 减少的体积就是生成水蒸气的体积 |
| A. | A | B. | B | C. | C | D. | D |
15.下列关于钠、钾的说法正确的是( )
①钠的熔点比钾的熔点高
②钠和钾在空气中燃烧的产物都是过氧化物
③钠和钾性质活泼且都是短周期元素
④钠和钾的合金常用作原子反应堆的导热剂
①钠的熔点比钾的熔点高
②钠和钾在空气中燃烧的产物都是过氧化物
③钠和钾性质活泼且都是短周期元素
④钠和钾的合金常用作原子反应堆的导热剂
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
16.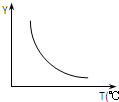 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表:
回答下列问题:
(1)该反应正向为△H>0;若该反应符合下图所示的关系,则在图中,Y轴是指CO2或H2的百分含量.
(2)能判断该反应达到化学平衡状态的依据是bc(多选扣分).
a.容器中压强不变 b.混合气体中c(CO)不变
c.v (H2)正=v (H2O)逆 d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:0.9•c(CO2)•c(H2)═c(CO)•c(H2O),由此可以判断此时的温度为800℃.其它条件不变,升高温度,原化学平衡向正反应方向移动(填“正”或“逆”),容器内混合气体的密度不变(填“增大”、“减小”或“不变”),气体平均相对分子质量不变(填“增大”、“减小”或“不变”).
(4)若在一密闭容器中,将一定量的CO与H2O混合加热到830℃下达到平衡.若反应开始时CO与H2O的浓度分别为0.200mol/L和0.100mol/L,平衡时CO的转化率33.3%.
 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表:| T℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应正向为△H>0;若该反应符合下图所示的关系,则在图中,Y轴是指CO2或H2的百分含量.
(2)能判断该反应达到化学平衡状态的依据是bc(多选扣分).
a.容器中压强不变 b.混合气体中c(CO)不变
c.v (H2)正=v (H2O)逆 d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:0.9•c(CO2)•c(H2)═c(CO)•c(H2O),由此可以判断此时的温度为800℃.其它条件不变,升高温度,原化学平衡向正反应方向移动(填“正”或“逆”),容器内混合气体的密度不变(填“增大”、“减小”或“不变”),气体平均相对分子质量不变(填“增大”、“减小”或“不变”).
(4)若在一密闭容器中,将一定量的CO与H2O混合加热到830℃下达到平衡.若反应开始时CO与H2O的浓度分别为0.200mol/L和0.100mol/L,平衡时CO的转化率33.3%.
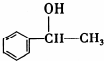 ,它不能发生的有机反应类型有④、⑥.
,它不能发生的有机反应类型有④、⑥.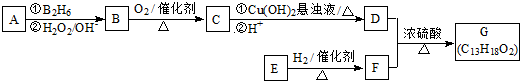
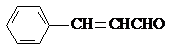 .
.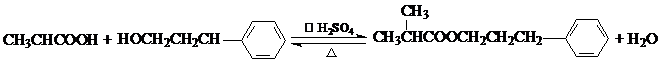 .
.