题目内容
11.用NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 11.2 L氧气中所含有的原子数为NA | |
| B. | 7.8g的Na2O2中含有的阴离子的数目为0.2NA | |
| C. | 0.10mol Fe 粉与足量水蒸气反应生成的H2分子数为0.10NA | |
| D. | 54g Al分别与足量的稀硫酸及氢氧化钠溶液反应失去的电子数都是6NA |
分析 A、没有说明是在标准状况下,故不能计算其物质的量;
B、每个过氧化钠中有一个阴离子;
C、铁和水蒸气反应每3摩尔铁生成4摩尔氢气;
D、54克铝是2mol,无论和酸还是和碱反应都显示+3价,即转移电子数为6NA.
解答 解:A、没有说明是在标准状况下,故不能计算其物质的量,故不选A;
B、每个过氧化钠中有一个阴离子,所以7.8克,即0.1mol的过氧化钠中含有阴离子数为0.1 NA,故不选B;
C、铁和水蒸气反应每3mol铁生成4mol氢气,故0.1mol铁,生成的氢气的分子数不是0.1 NA,故不选C;
D、54克铝是2mol,无论和酸还是和碱反应都显示+3价,即转移电子数为是6NA,故选D.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
2.下列说法中正确的是( )
| A. | 离子化合物中可能含有共价键,共价化合物中可能含有离子键 | |
| B. | 一定条件下1 mol N2与3 mol H2在密闭容器中充分反应可生成2 mol NH3 | |
| C. | 铁质器件附有铜质配件,在接触处易生铁锈 | |
| D. | 非极性共价键只存在于双原子单质分子里 |
19.断肠草为中国古代九大毒药之一,据记载能“见血封喉”,现代查明它是葫蔓藤科植物,含有的毒素很多,从中分离出来的四种毒素的结构简式分别为:

下列推断正确的是( )

下列推断正确的是( )
| A. | ①、②、③与④互为同分异构体 | |
| B. | ①、④互为同系物 | |
| C. | ③的分子式为C12H8O4 | |
| D. | 等物质的量②、④分别在足量氧气中完全燃烧,前者消耗氧气比后者少 |
6.已知:
C(s)+H2O(g)=CO(g)+H2(g)△H=+130kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-220kJ•mol-1
H-H、O=O键能分别为436、496kJ•mol-1,则O-H键能为( )
C(s)+H2O(g)=CO(g)+H2(g)△H=+130kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-220kJ•mol-1
H-H、O=O键能分别为436、496kJ•mol-1,则O-H键能为( )
| A. | 222 kJ•mol-1 | B. | 444 kJ•mol-1 | C. | 462 kJ•mol-1 | D. | 924 kJ•mol-1 |
16. 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表:
回答下列问题:
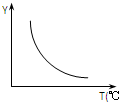
(1)该反应正向为△H>0;若该反应符合下图所示的关系,则在图中,Y轴是指CO2或H2的百分含量.
(2)能判断该反应达到化学平衡状态的依据是bc(多选扣分).
a.容器中压强不变 b.混合气体中c(CO)不变
c.v (H2)正=v (H2O)逆 d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:0.9•c(CO2)•c(H2)═c(CO)•c(H2O),由此可以判断此时的温度为800℃.其它条件不变,升高温度,原化学平衡向正反应方向移动(填“正”或“逆”),容器内混合气体的密度不变(填“增大”、“减小”或“不变”),气体平均相对分子质量不变(填“增大”、“减小”或“不变”).
(4)若在一密闭容器中,将一定量的CO与H2O混合加热到830℃下达到平衡.若反应开始时CO与H2O的浓度分别为0.200mol/L和0.100mol/L,平衡时CO的转化率33.3%.
 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表:| T℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应正向为△H>0;若该反应符合下图所示的关系,则在图中,Y轴是指CO2或H2的百分含量.
(2)能判断该反应达到化学平衡状态的依据是bc(多选扣分).
a.容器中压强不变 b.混合气体中c(CO)不变
c.v (H2)正=v (H2O)逆 d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:0.9•c(CO2)•c(H2)═c(CO)•c(H2O),由此可以判断此时的温度为800℃.其它条件不变,升高温度,原化学平衡向正反应方向移动(填“正”或“逆”),容器内混合气体的密度不变(填“增大”、“减小”或“不变”),气体平均相对分子质量不变(填“增大”、“减小”或“不变”).
(4)若在一密闭容器中,将一定量的CO与H2O混合加热到830℃下达到平衡.若反应开始时CO与H2O的浓度分别为0.200mol/L和0.100mol/L,平衡时CO的转化率33.3%.
20. 一定温度下,2L的密闭容器中,发生反应:A2(g)+3B2(g)?2AB3(g).A2在5min内物质的量由12mol变成了4mol.
一定温度下,2L的密闭容器中,发生反应:A2(g)+3B2(g)?2AB3(g).A2在5min内物质的量由12mol变成了4mol.
(1)该反应在这5min内的平均反应速率v(A2)=0.8 mol/(L•min).
(2)经过一段时间反应达到化学平衡状态,下列说法能充分说明该反应已达到化学平衡状态的是④.(填序号)
①A2、B2、AB3的浓度相等 ②正、逆反应速率均等于零
③A2、B2、AB3在容器中共存 ④A2、B2、AB3的浓度均不再改变
(3)下列条件不能改变该化学反应的限度的是④.(填序号)
①温度 ②浓度 ③压强 ④催化剂
(4)下列与改变化学反应速率无关的是③.(填序号)
①将食物存放在温度低的地方
②淀粉在淀粉酶的作用下发生水解反应
③铁粉与水蒸气的反应中,增加铁粉的用量
④将两种块状固体药品研细并混匀后再进行反应
(5)实验室可以利用稀硫酸与锌反应制取氢气.
①实验室用30%的稀硫酸溶液与锌粒反应制取氢气,反应进行一段时间后,气泡边得稀少了,锌粒还有剩余,再添加一些适当浓度的硫酸溶液到反应容器中,气泡又增多,其原因是浓度越大反应速率快.
②某学生为了探究锌与稀硫酸反应过程中速率变化.在100mL稀硫酸中加入足量的锌粉,标准状况下测得数据累计值如下:
在0~1、1~2、2~3、3~4、4~5min时间段中,反应速率最快的时间段是2~3min;0~5min内,化学反应速率变化的原因是H+浓度变小.
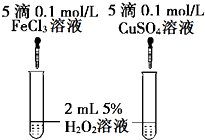
(6)经研究知Cu2+对H2O2分解具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学设计了如图甲、乙所示的实验.通过观察反应产生气泡的快慢,可定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是控制阴离子相同,排除阴离子的干扰.
 一定温度下,2L的密闭容器中,发生反应:A2(g)+3B2(g)?2AB3(g).A2在5min内物质的量由12mol变成了4mol.
一定温度下,2L的密闭容器中,发生反应:A2(g)+3B2(g)?2AB3(g).A2在5min内物质的量由12mol变成了4mol.(1)该反应在这5min内的平均反应速率v(A2)=0.8 mol/(L•min).
(2)经过一段时间反应达到化学平衡状态,下列说法能充分说明该反应已达到化学平衡状态的是④.(填序号)
①A2、B2、AB3的浓度相等 ②正、逆反应速率均等于零
③A2、B2、AB3在容器中共存 ④A2、B2、AB3的浓度均不再改变
(3)下列条件不能改变该化学反应的限度的是④.(填序号)
①温度 ②浓度 ③压强 ④催化剂
(4)下列与改变化学反应速率无关的是③.(填序号)
①将食物存放在温度低的地方
②淀粉在淀粉酶的作用下发生水解反应
③铁粉与水蒸气的反应中,增加铁粉的用量
④将两种块状固体药品研细并混匀后再进行反应
(5)实验室可以利用稀硫酸与锌反应制取氢气.
①实验室用30%的稀硫酸溶液与锌粒反应制取氢气,反应进行一段时间后,气泡边得稀少了,锌粒还有剩余,再添加一些适当浓度的硫酸溶液到反应容器中,气泡又增多,其原因是浓度越大反应速率快.
②某学生为了探究锌与稀硫酸反应过程中速率变化.在100mL稀硫酸中加入足量的锌粉,标准状况下测得数据累计值如下:
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(6)经研究知Cu2+对H2O2分解具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学设计了如图甲、乙所示的实验.通过观察反应产生气泡的快慢,可定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是控制阴离子相同,排除阴离子的干扰.

 .
.
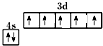 ,与D同周期的所有元素的基态原子中最外层电子数与D原子相同的元素有8种.
,与D同周期的所有元素的基态原子中最外层电子数与D原子相同的元素有8种.