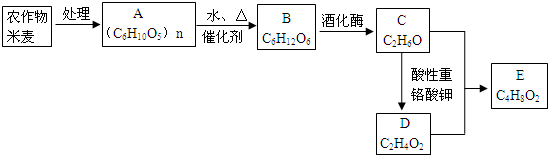
题目内容
4.在一定温度下,10mL0.50mol/L H2O2发生催化分解.不同时刻测定生成O2的体积(已折算为标准状况)如下表.| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.1 |
| A. | 0~6 min的平均反应速率:v(H2O2)≈0.33 mol/(L•min) | |
| B. | 6~10 min的平均反应速率:v(H2O2)>3.3×10-2 mol/(L•min) | |
| C. | 反应到6 min时,H2O2分解了60% | |
| D. | 反应到10 min时,c(H2O2)≈0.24 mol/L |
分析 A.0~6min时间内,生成氧气为$\frac{0.0224L}{22.4L/mol}$=0.001mol,则△c(H2O2)=0.002mol÷0.01L=0.2mol/L,根据v=$\frac{△c}{△t}$计算v(H2O2);
B.随着反应的进行,H2O2的浓度逐渐减小,反应速率减慢,小于0~6min时间内反应速率;
C.H2O2分解率=(H2O2浓度变化量÷H2O2起始浓度)×100%,结合A中计算判断;
D.根据氧气体积计算参加反应的过氧化氢物质的量,再计算过氧化氢浓度变化量,进而计算10min时c(H2O2).
解答 解:发生反应:2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2.
A.0~6min时间内,生成氧气为$\frac{0.0224L}{22.4L/mol}$=0.001mol,则△c(H2O2)=0.001mol×2÷0.01L=0.2mol/L,所以v(H2O2)=0.2mol/L÷6min≈0.033mol/(L•min),故A错误;
B.随着反应的进行,H2O2的浓度逐渐减小,反应速率减慢,6~10 min的平均反应速率小于0~6min时间内反应速率,故B错误;
C.6min时,H2O2分解率为:$\frac{0.2mol/L}{0.5mol/L}$×100%=40%,故C错误;
D.0~10min时间内,生成氧气为$\frac{0.0291}{22.4L/mol}$=0.0013mol,则△c(H2O2)=0.0013mol×2÷0.01L=0.26mol/L,所以10min时c(H2O2)=0.5mol/L-0.26mol/L=0.24mol/L,故D正确,
故选:D.
点评 本题考查化学平衡有关计算、化学反应速率计算、化学反应速率影响因素等,难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | NaHCO3溶液:HCO3-+H2O?CO32-+H3O+ | |
| B. | NaHS溶液:HS-+H2O?H2S+OH- | |
| C. | Na2CO3溶液:CO32-+2H2O?H2CO3+2OH- | |
| D. | Cl2溶于H2O中:Cl2+H2O═H++Cl-+HClO |
①钠的熔点比钾的熔点高
②钠和钾在空气中燃烧的产物都是过氧化物
③钠和钾性质活泼且都是短周期元素
④钠和钾的合金常用作原子反应堆的导热剂
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |

下列推断正确的是( )
| A. | ①、②、③与④互为同分异构体 | |
| B. | ①、④互为同系物 | |
| C. | ③的分子式为C12H8O4 | |
| D. | 等物质的量②、④分别在足量氧气中完全燃烧,前者消耗氧气比后者少 |
| A. | 12.3% | B. | 15.4% | C. | 13.4% | D. | 17.0% |
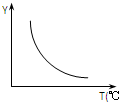 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表:| T℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应正向为△H>0;若该反应符合下图所示的关系,则在图中,Y轴是指CO2或H2的百分含量.
(2)能判断该反应达到化学平衡状态的依据是bc(多选扣分).
a.容器中压强不变 b.混合气体中c(CO)不变
c.v (H2)正=v (H2O)逆 d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:0.9•c(CO2)•c(H2)═c(CO)•c(H2O),由此可以判断此时的温度为800℃.其它条件不变,升高温度,原化学平衡向正反应方向移动(填“正”或“逆”),容器内混合气体的密度不变(填“增大”、“减小”或“不变”),气体平均相对分子质量不变(填“增大”、“减小”或“不变”).
(4)若在一密闭容器中,将一定量的CO与H2O混合加热到830℃下达到平衡.若反应开始时CO与H2O的浓度分别为0.200mol/L和0.100mol/L,平衡时CO的转化率33.3%.
| A. | CF4>CCl4>CBr4>CI4 | B. | Na>Mg>Al | ||
| C. | SiO2>H2O>CO2 | D. | 晶体硅>SiC>金刚石 |
 亚硝酸(HN02)在工业上用于有机合成,既具有氧化性又具有还原性,而且氧化性比还原性突出得多.回答下列问题:
亚硝酸(HN02)在工业上用于有机合成,既具有氧化性又具有还原性,而且氧化性比还原性突出得多.回答下列问题: