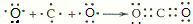题目内容
2. 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间变化如表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间变化如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
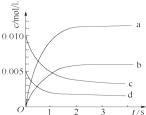
(2)如图中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v(O2)=1.5×10-3mol•L-1•s-1.
(3)能说明该反应已达到平衡状态的是BC.
A.v(NO2)=2v(O2)
B.容器内压强保持不变
C.v逆(NO)=2v正(O2)
D.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出NO2气体 B.适当升高温度 C.增大O2的浓度 D.选择高效催化剂.
分析 (1)平衡常数=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$,因为K300℃>K350℃,温度越高平衡常数越小,说明升温平衡逆向进行,正反应为放热反应,升温增大反应速率,正逆反应速率都增大;
(2)NO2是产物,随反应进行浓度增大,平衡时浓度为NO浓度的变化量△c(NO);根据v=$\frac{△c}{△t}$计算v(NO),再利用速率之比等于化学计量数之比计算v(O2);
(3)可逆反应达到平衡时,v正=V逆 (同种物质表示)或正逆速率之比等于化学计量数之比(不同物质表示),反应混合物各组分的物质的量、浓度、含量不再变化,以及由此衍生的一些量也不发生变化,由此进行判断;
(4)外界条件增加,反应速率加快,正反应是放热反应,升高温度不行,只能增加反应物的浓度,使用催化剂平衡不移动.
解答 解:(1)2NO(g)+O2(g)?2NO2(g),平衡常数=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)c({O}_{2})}$,因为K300℃>K350℃,温度越高平衡常数越小,说明升温平衡逆向进行,正反应为放热反应,升温增大反应速率,正逆反应速率都增大;
故答案为:$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)c({O}_{2})}$;放;增大;
(2)NO2是产物,随反应进行浓度增大,平衡时浓度为NO浓度的变化量△c(NO)=$\frac{0.020mol-0.007mol}{2L}$=0.0065mol/L,结合图象纵轴数据分析,图中表示NO2变化的曲线是b,
2s内用NO表示的平均反应速率v(NO)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.0020mol-0.008mol}{2L}}{2s}$=3.0×10-3mol•L-1•s-1,速率之比等于化学计量数之比,
所以v(O2)=$\frac{1}{2}$v(NO)=$\frac{1}{2}$×3.0×10-3mol•L-1•s-1=1.5×10-3mol•L-1•s-1,
故答案为:b;1.5×10-3 mol•L-1•s-1;
(3)A、表示同一方向反应速率,v(NO2)自始至终为v(O2)的2倍,不能说明达到平衡,故A错误;
B、随反应进行,反应混合气体总的物质的量在减小,气体总物质的量保持不变,气体压强不变,说明反应到达平衡,故B正确;
C、不同物质表示速率,到达平衡时,正逆速率之比等于化学计量数之比,V逆 (NO):正(O2)=2:1,即V逆 (NO)=2v正(O2),故C正确;
D、混合气体的总质量不变,容器容积为定值,所以密度自始至终不变,不能说明达到平衡,故D错误.
故答案为:BC;
(4)A.及时分离出NO2气体减小生成物浓度反应速率减小,故A不符合;
B.适当升高温度反应速率增大,但该反应是放热反应,升温平衡逆向进行,故B不符合;
C.增大O2的浓度增大反应物浓度,平衡正向进行,反应速率增大,故C符合;
D.选择高效催化剂.催化剂同等程度改变正逆反应速率,使用催化剂平衡不移动,故D不符合;
故选:C.
点评 本题主要考查反应速率、平衡平衡状态的判断及读图表能力,难度中等,判断平衡时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 1000 mL | B. | 500 mL | C. | 100 mL | D. | 50 mL |
| A. | 11g | B. | 17g | C. | 44g | D. | 22g |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅤⅠA | ⅤⅡA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | J | K | ||
| 4 | L | M |
(2)写出C元素的气态氢化物与I元素的最高价氧化物的水化物反应的化学方程式:2NH3+H2SO4=(NH4)2SO4.
(3)将C、D、E三种元素的氢化物按还原性增强的顺序排列为HF<H2O<NH3.(用化学式表示)
(4)I2-、J-、L+、M2+等微粒中,半径最大的是S2-(填离子符号).
(5)A与D形成的化合物A2D2是共价化合物(填共价或离子),其电子式为
 .
. 
| A. | M的分子式为C12H9O3 | |
| B. | 1mol M在最多能与6molH2发生加成反应 | |
| C. | M与N可用试剂组合:溴水、NaOH溶液鉴别 | |
| D. | M与N可用试剂组合:FeCl3溶液、稀H2SO4鉴别 |
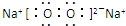 写出B的氢化物的结构式:
写出B的氢化物的结构式: 用电子式表示A、C两元素形成AC2的过程:
用电子式表示A、C两元素形成AC2的过程: