题目内容
11.下表列出了A~M 13种元素在周期表中的位置:| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅤⅠA | ⅤⅡA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | J | K | ||
| 4 | L | M |
(2)写出C元素的气态氢化物与I元素的最高价氧化物的水化物反应的化学方程式:2NH3+H2SO4=(NH4)2SO4.
(3)将C、D、E三种元素的氢化物按还原性增强的顺序排列为HF<H2O<NH3.(用化学式表示)
(4)I2-、J-、L+、M2+等微粒中,半径最大的是S2-(填离子符号).
(5)A与D形成的化合物A2D2是共价化合物(填共价或离子),其电子式为
 .
.
分析 根据元素在周期表中的位置知,A、B、C、D、E、F、G、H、I、J、K、L、M分别是H、C、N、O、F、Na、Mg、Al、S、Cl、Ar、K、Ca元素,
(1)这些元素中,金属性最强的元素位于周期表左下角,非金属性最强的位于周期表右上角,但稀有气体除外,最不活泼的元素是稀有气体元素;
(2)C的气态氢化物是氨气、I的最高价氧化物的水化物是硫酸,二者反应生成硫酸铵或硫酸氢铵,写一个即可;
(3)同一周期,随着原子序数的递增,非金属性增强,氢化物还原性减弱,据此解答即可;
(4)核外电子排布相同的微粒,原子序数越小,半径越大,据此解答即可;
(5)双氧水为共价化合物,据此解答即可.
解答 解:根据元素在周期表中的位置知,A、B、C、D、E、F、G、H、I、J、K、L、M分别是H、C、N、O、F、Na、Mg、Al、S、Cl、Ar、K、Ca元素,
(1)这些元素中,金属性最强的元素位于周期表左下角,为K元素,名称为钾,非金属性最强的位于周期表右上角,为F元素,名称为氟,最不活泼的元素是稀有气体元素,为Ar元素,原子半径最小的元素是H,故答案为:钾;氟;Ar;H;
(2)C的气态氢化物是氨气、I的最高价氧化物的水化物是硫酸,二者反应生成硫酸铵,反应方程式为2NH3+H2SO4=(NH4)2SO4,
故答案为:2NH3+H2SO4=(NH4)2SO4;
(3)同周期自左而右非金属性增强,非金属性越强,氢化物还原性越弱,故氢化物还原性:HF<H2O<NH3,故答案为:HF<H2O<NH3;
(4)S2-、Cl-、K+、Ca2+是核外电子排布相同的离子,原子序数越小,半径越大,故微粒中S2-的半径最大,Ca2+的半径最小,故答案为:S2-;
(5)双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ,故答案为:共价;
,故答案为:共价; .
.
点评 本题主要考查元素周期表和元素周期律综合应用,明确元素非金属性、金属性强弱判断方法即可解答,熟练掌握元素周期律并灵活运用,题目难度不大.

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案| A. | 碘元素 | B. | 铁元素 | C. | 钾元素 | D. | 锌元素 |
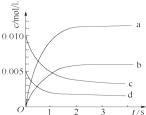 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间变化如表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间变化如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v(O2)=1.5×10-3mol•L-1•s-1.
(3)能说明该反应已达到平衡状态的是BC.
A.v(NO2)=2v(O2)
B.容器内压强保持不变
C.v逆(NO)=2v正(O2)
D.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出NO2气体 B.适当升高温度 C.增大O2的浓度 D.选择高效催化剂.
| A. | 分子式相同的不同物质一定是同分异构体 | |
| B. | 通式相同的不同物质一定属于同系物 | |
| C. | 相对分子质量相同的不同物质一定是同分异构体 | |
| D. | 分子式相同,元素的质量分数也相同的物质是同种物质 |
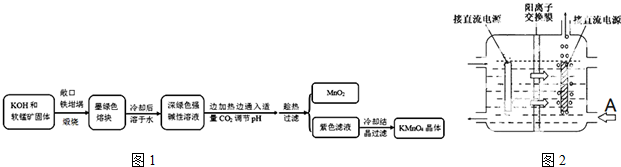
相关资料:
①物质溶解度
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42-会发生歧化反应.
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚的理由是高温下强碱会和瓷坩埚中的二氧化硅反应腐蚀坩埚;实验中用铁坩埚煅烧暴露在空气中的固体混合物发生反应的化学方程式为2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O.
(2)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低.请写出实验中通入适量CO2时体系中可能发生反应离子方程式:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-,2OH-+CO2═CO32-+H2O;其中氧化还原反应中氧化剂和还原剂的质量比为1:2.
(3)由于CO2的通人量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸.从理论上分析,选用下列酸中A,得到的产品纯度更高.
A.醋酸 B.浓盐酸 C.稀硫酸
(4)工业上一般采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式2K2MnO4+2H2O$\frac{\underline{\;高温\;}}{\;}$2KMnO4+H2↑+2KOH;
传统工艺采用无膜电解法由于副反应发生,Mn元素利用率和电流效率都会偏低.有同学联想到离子交换膜法电解饱和食盐水提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图2).图中A口加入的溶液最好为KOH溶液.使用阳离子交换膜可以提高Mn元素利用率的原因为阳离子交换膜防止锰酸根进入阴极区被还原.
| A. | pH可能等于7 | |
| B. | c(HCO3- )=c(CH3COO-) | |
| C. | c(OH-)=$\frac{c(C{H}_{3}COOH)Kw}{c(C{H}_{3}CO{O}^{-})Ka}$ | |
| D. | c(HCO3- )+c(H2CO3)+c(CO3 2-)=c(CH3COOH)+c(CH3COO-) |
| A. | ①③ | B. | ②③ | C. | ①②③ | D. | ②③④ |
 ;
;