题目内容
7.恒温下,将amol N2与bmol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)??2ΝΗ3(g)(1)若反应进行到某时刻t时,nt(N2)=8mol,nt(NH3)=4mol,计算a的值.
(2)反应达平衡时,混合气体的体积为537.6L(标准状况下),其中NH3的体积分数为25%.求原混合气体中,a:b=1:2.
(3)平衡混合气体中,n(N2):n(H2):n(NH3)=7:11:6.计算过程:
分析 恒温下,将amol N2与bmol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)??2ΝΗ3(g)
(1)依据化学平衡三段式列式计算
N2(g)+3H2(g)??2ΝΗ3(g)
起始量 a b 0
变化量 2 6 4
某时刻量 8 b-6 4
(2)N2(g)+3H2(g)??2ΝΗ3(g),反应后气体物质的量进行为生成氨气的物质的量,反应达平衡时,混合气体的体积为537.6L(标准状况下),其中NH3的体积分数为25%,平衡时混合气体物质的量:n平=$\frac{537.6L}{22.4L/mol}$=24mol
n平(NH3)=6mol
n始=30mol;
即a+b=30
因a=10,得到b为20,
(3)依据上述分析和计算得到平衡状态下各气体物质的量之比;
解答 解:(1)依据化学平衡三段式列式计算
N2(g)+3H2(g)??2ΝΗ3(g)
起始量 a b 0
变化量 2 6 4
平衡量 8 b-6 4
由反应的化学方程式得知,反应掉的N2和生成的NH3的物质的量之比为1:2,设反应掉的N2的物质的量为x.
则x:4mol=1:2
解得:x=2mol
若反应进行到某时刻t时,nt(N2)=8mol,nt(NH3)=4mol,
得到氮气的起始量:a=8mol+2mol=10mol;
答:若反应进行到某时刻t时,nt(N2)=8mol,nt(NH3)=4mol,得到a的值为10;
(2)平衡时混合气体物质的量:n平=$\frac{537.6L}{22.4L/mol}$=24mol
n平(NH3)=6mol
n始=30mol;
即a+b=30
因a=10,得到b为20,
所以a:b=10:20=1:2;
故答案为:1:2;
(3)N2(g)+3H2(g)??2ΝΗ3(g)
起始量 10 20 0
变化量 3 9 6
平衡量 7 11 6
平衡时:n(NH3)=6mol,n(N2)=7mol,n(H2)=11mol,
平衡混合气体中,n(N2):n(H2):n(NH3)=7:11:6;
故答案为:7:11:6.
点评 本题考查了化学平衡的分析应用,主要是反应特征和定量关系的分析应用,计算过程和方法是解题关键,掌握基础是解题关键,题目难度中等.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案| A. | Li | B. | Na | C. | Rb | D. | Mg |
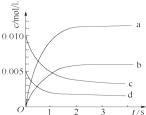 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间变化如表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间变化如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v(O2)=1.5×10-3mol•L-1•s-1.
(3)能说明该反应已达到平衡状态的是BC.
A.v(NO2)=2v(O2)
B.容器内压强保持不变
C.v逆(NO)=2v正(O2)
D.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出NO2气体 B.适当升高温度 C.增大O2的浓度 D.选择高效催化剂.
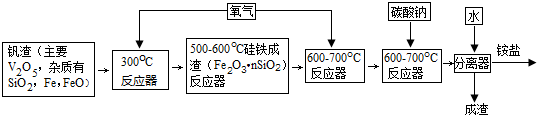
(1)V2O5与氢氧化钠反应的离子方程式:V2O5+6OH-=2VO43-+3H2O.
(2)300℃反应器主要目的是把铁氧化为四氧化三铁.
(3)600-700℃反应器通入氧气的目的是把四氧化三铁氧化为氧化铁.
(4)加入铵盐后,通过过滤、洗涤和干燥得到纯净的“黄饼”(NH4)6V10O28•nH2O.洗涤“黄饼”选用合适的试剂是C.
A.1%的氨水 B.1%的铵盐 C.5%的酒精 D.蒸馏水
(5)①“黄饼”(NH4)6V10O28•nH2O含“结晶水”占质量的20.21%,则n为15.
②对上述“黄饼”133.6g进行热重分析:
| 温度K | 293 | 373 | 773 |
| 质量(g) | 133.6 | 106.6 | 91.0 |
| A. | 分子式相同的不同物质一定是同分异构体 | |
| B. | 通式相同的不同物质一定属于同系物 | |
| C. | 相对分子质量相同的不同物质一定是同分异构体 | |
| D. | 分子式相同,元素的质量分数也相同的物质是同种物质 |
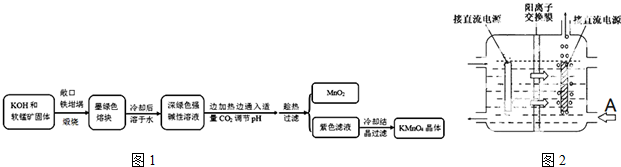
相关资料:
①物质溶解度
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42-会发生歧化反应.
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚的理由是高温下强碱会和瓷坩埚中的二氧化硅反应腐蚀坩埚;实验中用铁坩埚煅烧暴露在空气中的固体混合物发生反应的化学方程式为2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O.
(2)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低.请写出实验中通入适量CO2时体系中可能发生反应离子方程式:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-,2OH-+CO2═CO32-+H2O;其中氧化还原反应中氧化剂和还原剂的质量比为1:2.
(3)由于CO2的通人量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸.从理论上分析,选用下列酸中A,得到的产品纯度更高.
A.醋酸 B.浓盐酸 C.稀硫酸
(4)工业上一般采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式2K2MnO4+2H2O$\frac{\underline{\;高温\;}}{\;}$2KMnO4+H2↑+2KOH;
传统工艺采用无膜电解法由于副反应发生,Mn元素利用率和电流效率都会偏低.有同学联想到离子交换膜法电解饱和食盐水提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图2).图中A口加入的溶液最好为KOH溶液.使用阳离子交换膜可以提高Mn元素利用率的原因为阳离子交换膜防止锰酸根进入阴极区被还原.
| A. | 浓硫酸具有吸水性,可用于干燥二氧化碳、硫化氢等气体 | |
| B. | 氨气极易溶于水,可用作制冷剂 | |
| C. | 浓硝酸在常温下能使铝钝化,可用铝槽车运输浓硝酸 | |
| D. | SO2具有强还原性,在空气中极易被氧化为SO3 |