题目内容
8.某有机物3.24g装入元素分析装置,通入足量的氧气使之完全燃烧,将生成的气体依次通过无水CaCl2(A)管和碱 石灰(B)管,测的A管增重2.16g,B管增重9.24g,已知该有机物的相对分子质量小于200.求该有机物的实验式和化学式.分析 A管质量增加了2.16g为生成水的质量,B管质量增加了9.24g为生成二氧化碳的质量,根据n=$\frac{m}{M}$计算有机物、水、二氧化碳的物质的量,根据质量守恒计算有机物分子中N(C)、N(H),再根据有机物的相对分子质量计算分子中N(O),据此解答.
解答 解:(1)试管A吸水质量增加2.16g,为生成水的质量,水的物质的量=$\frac{2.16g}{18g/mol}$=0.12mol,含H 0.24mol,氢元素的质量为0.24g,
碱石灰吸CO2增加9.24g,即生成二氧化碳的物质的量=$\frac{2.94g}{44g/mol}$=0.21mol,碳元素的质量为0.21mol×12=2.52g,氧元素的质量:3.24-0.24-2.52=0.48g,
氧元素的物质的量$\frac{0.48}{16}$mol=0.03mol.
N(C):N(H):N(O)=0.21mol:0.24mol:0.03mol=7:8:1
所以有机物的实验式为:C7H8O;
C7H8O的分子量为108,(C7H8O)n小于200,n=1,
答:实验式为C7H8O;化学式C7H8O.
点评 本题考查有机物分子式的计算,题目难度中等,本题注意根据有机物燃烧产物的质量关系确定有机物的分子式,为解答该题的关键.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
18.硫酸的消耗量是衡量一个国家化学工业发展水平的重要标志,H2SO4的相对分子质量为( )
| A. | 34 | B. | 98 | C. | 114 | D. | 128 |
16.医生建议患甲状腺肿大的病人多食海带,这是由于海带中含有较丰富的( )
| A. | 碘元素 | B. | 铁元素 | C. | 钾元素 | D. | 锌元素 |
20.某对酸性溶液进行下列操作:①灼烧,火焰呈蓝色;②加BaCl2出现白色沉淀;③浓缩后加浓H2SO4和铜片共热产生红棕色气体,则此溶液中,可能存在的离子是( )
| A. | Na+、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$ | B. | K+、NO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$ | ||
| C. | Na+、K+、SO${\;}_{3}^{2-}$ | D. | Na+、NO${\;}_{3}^{-}$、SO${\;}_{3}^{2-}$ |
2.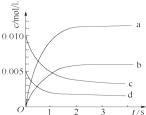 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间变化如表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间变化如表:
(1)写出该反应的平衡常数表达式:K=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)c({O}_{2})}$.已知:K(300℃)>K(350℃),则该反应正反应是放热反应.升高温度,正反应速率增大(填“增大”、“减小”或“不变”).
(2)如图中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v(O2)=1.5×10-3mol•L-1•s-1.
(3)能说明该反应已达到平衡状态的是BC.
A.v(NO2)=2v(O2)
B.容器内压强保持不变
C.v逆(NO)=2v正(O2)
D.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出NO2气体 B.适当升高温度 C.增大O2的浓度 D.选择高效催化剂.
 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间变化如表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间变化如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v(O2)=1.5×10-3mol•L-1•s-1.
(3)能说明该反应已达到平衡状态的是BC.
A.v(NO2)=2v(O2)
B.容器内压强保持不变
C.v逆(NO)=2v正(O2)
D.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出NO2气体 B.适当升高温度 C.增大O2的浓度 D.选择高效催化剂.
3.25℃时,物质的量浓度相等的NaHCO3、CH3COONa混合溶液中,下列有关说法或粒子浓度关系正确的是(Ka表示CH3COOH的电离平衡常数).
| A. | pH可能等于7 | |
| B. | c(HCO3- )=c(CH3COO-) | |
| C. | c(OH-)=$\frac{c(C{H}_{3}COOH)Kw}{c(C{H}_{3}CO{O}^{-})Ka}$ | |
| D. | c(HCO3- )+c(H2CO3)+c(CO3 2-)=c(CH3COOH)+c(CH3COO-) |
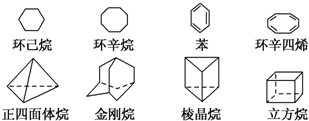 如图是八种环状的烃类物质:
如图是八种环状的烃类物质: 1,4-二甲苯、
1,4-二甲苯、 1,3,5-三甲苯.
1,3,5-三甲苯.